Nghiên cứu sản xuất Niken Sunfat NiO4 từ quặng chứa Niken của mỏ Cromit Cổ Định - Thanh Hóa - Việt Nam
06/12/2017
Mục tiêu nghiên cứu là xây dựng một qui trình công nghệ sản xuất niken sunfat từ là crômit Cổ Định-Thanh Hóa có hàm lượng ≈99,0% NiSO4.6H2O. Đây là công trình đầu tiên nghiên cứu thu hồi niken từ quặng niken dạng ôxyt, là quặng chứa niken sau khi tuyển crômit.
Production of NiSO4 from nickelrich ores of Co Dinh chromite
Lê Hồng Sơn, Nguyễn Văn Chiến, Lê Gia Mô Viện KH và CN Mỏ-Luyên kim
Tóm tắt
Đã nghiên cứu các yếu tố ảnh hưởng đến quá trình hòa tách quặng niken theo phương pháp Caron, các yếu tố ảnh hưởng đến quá trình hòa tan muối niken cacbonat bazơ, các yếu tố ảnh hưởng đến quá trình làm sạch dung dịch hòa tan. Trên cơ sở đó đã đề nghị một sơ đồ công nghệ sản xuất niken sunfat NiSO4 từ tinh quặng niken (1,2%Ni).
1. Mở đầu
Việt Nam chưa sản xuất được niken dùng cho các ngành công nghiệp nhưng lại có nguồn quặng chứa niken đáng kể. Mỏ crômit Cổ Định-Thanh Hóa thuộc loại lớn trong khu vực nhưng việc khai thác mới dừng ở việc chế biến thô, chưa tận thu được các nguyên tố có ích đi kèm như côban, niken. Sản phẩm của mỏ là tinh quặng crômit với hàm lượng crôm ôxyt (43,0÷46,0)% Cr2O3 chủ yếu để xuất khẩu. Đề tài nghiên cứu cấp Nhà Nước KC-02.17/06-10: “Nghiên cứu hoàn thiện quy trình công nghệ tuyển và sử dụng hợp lý quặng crômit và các khoáng sản đi kèm trong mỏ crômit Cổ Định-Thanh Hóa” là căn cứ khoa học khi lập các dự án khai thác chế biến tổng hợp quặng cromit mỏ Cổ Định-Thanh Hóa. Mục tiêu nghiên cứu là xây dựng một qui trình công nghệ sản xuất niken sunfat từ là crômit Cổ Định-Thanh Hóa có hàm lượng ≈99,0% NiSO4.6H2O. Ở việt Nam đã có những nghiên cứu về luyện niken từ quặng sunfua và đã có những kết quả ban đầu. Đối với quặng ôxyt vẫn còn bỏ ngỏ vì tính phức tạp của quy trình công nghệ, hàm lượng niken trong quặng thấp, khó tuyển. Đây là công trình đầu tiên nghiên cứu thu hồi niken từ quặng niken dạng ôxyt, là quặng chứa niken sau khi tuyển crômit.
2. Thực nghiệm
Mẫu quặng có thành phần hóa học như bảng 1.
Bảng 1 : Thành phần hóa học tinh quặng niken
| TT | Mẫu nghiên cứu |
Hàm lượng (%) |
|||||
| Ni | Co | Fe2O3 | Cr | Al2O3 | Cu(ppm) | ||
| 1 | Tinh quặng Ni | 1,22 | 0,17 | >20 | 1,28 | 1,86 | <5 |
Từ nghiên cứu thấy rằng để thu hồi niken từ quặng cromit Cổ Định-Thanh Hóa cần tiến hành xử lý theo phương pháp Caron. Mẫu được thiêu hoàn nguyên ở 1000°C, hòa tách trong dung dịch NH3 có sục khí CO2 và O2. Dung dịch được chưng cất thu hồi muối niken cacbonat bazơ, sau đó hòa tan muối bằng axit sunfuric, làm sạch dung dịch và kết tinh thu hồi sản phẩm NiSO4.6H2O.
3. Kết quả và thảo luận
3.1. Nghiên cứu quá trình hòa tách
Điệu kiện thí nghiệm: Mẫu nghiên cứu có khối lượng 100g được thiêu hoàn nguyên ở 1000°C trong thời gian 120 phút với 4% C và 2% phụ gia. Thiêu phẩm được nghiền đến cỡ 0,074 mm và hòa tách bằng dung dịch NH3 có nồng độ thay đổi từ (40÷80) g/lít, nồng độ CO2 thay đổi từ (20÷60)g/l, thời gian thay đổi (30÷180) phút, tỷ lệ L/R thay đổi từ (2÷5), tốc độ khuấy thay đổi từ (15÷90) vòng/phút, tốc độ sục khí thay đổi từ (1÷6) lít/phút, nhiệt độ hòa tách thay đổi từ (30÷90) °C. Bã được lọc chân không và rửa bằng nước, sấy khô ở nhiệt độ 105°C đến khối lượng không đổi. Phân tích hàm lượng niken còn lại trong bã có thể tính được hiệu suất thu hồi ni ken hòa tách.
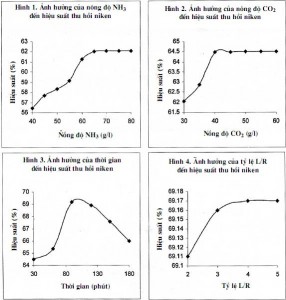
3.1.1. Ảnh hưởng của nồng độ NH3
Mẫu được hòa tách trong thời gian 30 phút, với tỷ lệ L/R=3, nhiệt độ hòa tách 30°C, nồng độ CO2 30g/lít, tốc độ sục khí 2 lít/phút. Nồng độ NH3 thay đổi từ (40÷80)g/lít. Kết quả cho thấy ở nồng độ NH3 là 65 g/lít cho hiệu suất thu hồi tối ưu (hình 1).
3.1.2. Ảnh hưởng của nồng độ CO2
Mẫu được hòa tách trong thời gian 30 phút, với tỷ lệ L/R=3, nhiệt độ hòa tách 30°C, nồng độ NH3 65 g/lít, tốc độ sục khí 2 lít/phút. Nồng độ CO2 thay đổi từ (30÷60) g/lít. Kết quả cho thấy ở nồng độ CO2 là 50 g/lít cho hiệu suất thu hồi hợp lý (hình 2).
3.1.3. Ảnh hưởng của thời gian hòa tách
Mẫu nghiên cứu được hòa tách với tỷ lệ L/R=3, nhiệt độ hòa tách 30°C, nồng độ CO2 40 g/lít, nồng độ NH3 65 g/lít, tốc độ sục khí 2 lít/phút. Thời gian hòa tách thay đổi từ (30÷180) phút. Kết quả cho thấy ở thời gian là 90 phút cho hiệu suất thu hồi tối ưu (hình 3).
3.1.4. Ảnh hưởng của tỷ lệ L/R khi hòa tách
Mẫu nghiên cứu được hòa tách trong thời gian 90phút, nhiệt độ hòa tách 30°C, nồng độ NH3 65g/lít, nồng độ CO2 30g/lít, nồng độ NH3 65g/lít. Tỷ lệ L/R thay đổi từ (2÷5). Kết quả cho thấy ở tỷ lệ L/R=3 cho hiệu suất thu hồi hợp lý (hình 4).
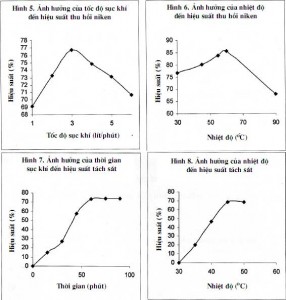
3.1.5. Ảnh hưởng của tốc độ sục khí
Mẫu nghiên cứu được hòa tách trong thời gian 90 phút, với tỷ lệ L/R=3, nhiệt độ hòa tách 30°C,nồng độ CO2 30g/lít, nồng độ NH3 65 g/lít. Tốc độ sục khí thay đổi từ (1÷6) lít/phút. Kết quả cho thấy ở tốc độ sục khí là 3 lít/phút cho hiệu suất thu hồi tối ưu (hình 5).
3.1.6. Ảnh hưởng của nhiệt độ
Mẫu nghiên cứu được hòa tách trong thời gian 90 phút, với tỷ lệ L/R=3, nồng độ NH3 65g/lít, nồng độ CO2 30g/lít, tốc độ sục khí 3 lít/phút. Nhiệt độ hòa tách thay đổi từ (30÷90) °C. Kết quả cho thấy ở nhiệt độ 60°C hiệu suất thu hồi tối ưu (hình 6).
3.2. Nghiên cứu quá trình chưng cất
Điều kiện thí nghiệm: Mẫu dung dịch chứa niken có thể tích 1000 ml. Tiến hành sơ bộ loại sắt bằng cách sục khí ở thời gian thay đổi từ (15÷90) phút, nhiệt độ thay đổi từ (30÷70) °C. Sau đó chưng cất dung dịch hòa tách ở nhiệt độ thay đổi từ (50÷120) °C, thời gian chưng cất thay đổi từ (30÷180) phút. Phân tích hàm lượng niken trong cặn và lượng amoniăc thu hồi được có thể tính được hiệu suất thu hồi niken và amôniac khi chưng cất.
3.2.1. Ảnh hưởng của thời gian sục khí đến khả năng tách sắt
Mẫu được sục khí ở nhiệt độ 30°C với thời gian thay đổi từ (15÷90) phút. Kết quả cho thấy ở thời gian sục khí là 60 phút cho hiệu suất tách sắt hợp lý (hình 7).
3.2.2. Ảnh hưởng của nhiệt độ khi sục khí đến khả năng tách sắt
Mẫu được sục khí trong thời gian 60 phút với nhiệt độ thay đổi từ (30÷70) °C. Kết quả cho thấy ở nhiệt độ khi sục khí là 45°C cho hiệu suất tách sắt hợp lý (hình 8).
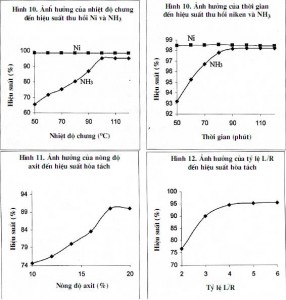
3.2.3. Ảnh hưởng của nhiệt độ chưng
Mẫu được chưng cất trong thời gian 60 phút với nhiệt độ chưng thay đổi từ 50 đến 120°C.
Kết quả nghiên cứu cho thấy ở nhiệt độ chưng 100°C cho hiệu suất thu hồi hợp lý (hình 9).
3.2.4. Ảnh hưởng của thời gian chưng
Mẫu được chưng cất ở nhiệt độ chưng 100°C, thời gian chưng thay đổi từ 30 đến 180 phút. Kết quả nghiên cứu cho thấy ở thời gian chưng 90 phút cho hiệu suất thu hồi hợp lý (hình 10).
3.3. Nghiên cứu quá trình hòa tan niken cacbônat bazơ
Điều kiện thí nghiệm: Mẫu muối niken bazơ cacbônat có khối lượng 10 g được tiến hành hòa tan bằng dung dịch axit sunfuric H2SO4 có nồng độ thay đổi từ (10÷20)%, nhiệt độ thay đổi từ (30÷80) °C, tỷ lệ L/R thay đổi từ (2÷5), thời gian thay đổi từ (30÷180) phút, tốc độ khuấy thay đổi từ (15÷90) v/phút. Sau khi kết thúc quá trình bã được lọc chân không và sấy khô ở nhiệt độ 105°C đến khối lượng không đổi. Phân tích hàm lượng niken còn lại trong cặn rắn còn lại có thể tính được hiệu suất thu hồi niken.
3.3.1. Ảnh hưởng của nồng độ axit
Mẫu được hòa tan trong thời gian 10 phút, tỷ lệ L/R=3, nhiệt độ hòa tan 30°C. Nồng độ axit thay đổi từ (10÷20)%. Kết quả cho thấy ở nồng độ dung dịch 18% cho hiệu suất thu hồi hợp lý (hình 11).
3.3.2. Ảnh hưởng của tỷ lệ L/R
Mẫu được hòa tan trong thời gian 10 phút, nồng độ axit 18%, nhiệt độ hòa tan 30°C. Tỷ lệ L/R thay đổi từ (2÷6). Kết quả cho thấy ở tỷ lệ L/R=5 cho hiệu suất thu hồi hợp lý (hình 12).
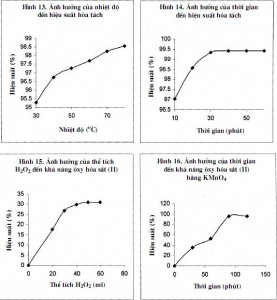
3.3.3. Ảnh hưởng của nhiệt độ
Mẫu được hòa tan trong thời gian 10 phút, nồng độ axit 18%, tỷ lệ L/R=5. Nhiệt độ thay đổi từ (30÷80) oC. Kết quả cho thấy ở nhiệt độ 50°C cho hiệu suất thu hồi hợp lý (hình 13).
3.3.4. Ảnh hưởng của thời gian hòa tan
Mẫu được hòa tan trong dung dịch axit 18%, tỷ lệ L/R=5, nhiệt độ 50°C. Thời gian thay đổi từ (10÷60) phút. Kết quả cho thấy ở 30 phút cho hiệu suất thu hồi hợp lý (hình 14).
3.4. Quá trình thu hồi sản phẩm sunfat niken
3.4.1. Nghiên cứu khả năng ôxy hóa sắt bằng H2O2
Mẫu dung dịch được xử lý tạp chất trong thời gian 30 phút, nhiệt độ 30°C. Lượng thể tích H2O2 đưa vào thay đổi từ 0 đến 60 ml. Kết quả cho thấy khả năng oxy hóa sắt (II) thành sắt (III) của H2O2 Cho hiệu suất oxy hóa đạt 18,00% (hình 15).
3.4.2. Nghiên cứu khả năng oxy hóa sắt bằng KMnO4
Mẫu dung dịch dược xử lý tạp bằng 2 ml KMnO4 2% trong thời gian thay đổi từ 0 đến 120 phút. Kết quả nghiên cứu cho thấy có thể oxy hóa sắt (II) thành sắt (III) trong thời gian 90 phút (hình 16).
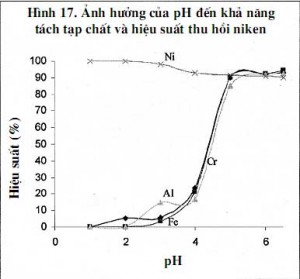
3.4.3. Nghiên cứu ảnh hưởng của pH đến khả năng tách tạp chất
Mẫu được điều chỉnh pH=6,5 bằng tác nhân Ca(OH)2. Kết quả thí nghiệm cho thấy quá trình làm sạch bằng phương pháp thủy phân khi điều chỉnh pH dung dịch hòa tách bằng dung dịch Ca(OH)2 đến pH=6,5 thì hầu hết sắt, nhôm, crom một lượng mangan rất nhỏ đã kết tủa (hình 17).
3.4.4. Quá trình thu hồi sản phẩm
Dung dịch chứa niken đã làm sạch tạp chất được cô để giảm bớt thể tích, tiến hành kết tinh với sự có mặt của axit sunfuric trong thời gian 10 giờ. Chất lượng của sản phẩm niken sunfat kết tinh được đưa ra ở bảng 2. Tổng suất thu hồi Niken là (70÷76)%.
| Cấu tử | Ni | Pb | Zn | Cu | Co | Fe | Ca |
| Sản phẩm NiSO4.6H2O | 21,14 | 0,0001 | - | 0,0001 | - | 0,018 | 1,20 |
Bảng 2. Thành phần hóa học mẫu sản phẩm
4. Kết luận
1. Đã nghiên cứu thu hồi được niken trong quặng crômit Cổ Định-Thanh Hóa với thực thu của niken đạt 74,63 % và chất lượng sản phẩm niken sunfat đạt 21,14%.
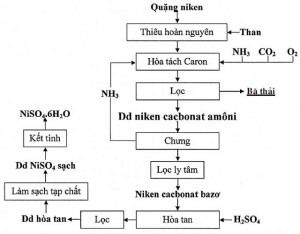
2. Đã xác định được sơ đồ công nghệ thu hồi niken sunfat từ quặng niken như hình 18.
Hình 18. Sơ đồ dây chuyền công nghệ xử lý quặng ôxit niken mỏ crômit Cổ Định
[symple_box color="white" text_align="left" width="100%" float="none"]
Tài liệu tham khảo
- Phạm Kim Đĩnh, Lê Xuân Khuông, v.v...; Lý thuyết các quá trình luyện kim. Nxb KH& KT Hà Nội, 1996
- IU.V. Kanak ln, I.I. Angelov, Hoá chất tinh khiết. Nxb KH&KT, Hà Nội, 1990 Người dịch: Lê Chí Kiên (In lần thứ 3 có sửa chữa và bổ xung).
- Luyện kim loại màu, Nxb Đại học và trung học chuyên nghiệp, 1981
- Nguyễn Đức Vận, Hóa học vô cơ T2, Nxb KH&KT, Hà Nội, 1999 8. J. E.Silva, D. Soares et all, Leaching behaviour of a galvanic sludge in sulfuric acid and ammoniacal media Joumal of Hazardous material, B121, 2005
- DR. Ashok, Dalor, D.W. Cordon Bacon; The past and the future of nikel laterite, Inco Ld, 2004
- Stella Agatzini Leonardou; Beneficiation of a Greek serpentinic nickeliferous ore, Part II, Sulphuric acid heap and agitation leaching, 2004
- B.Harris, J. Magee; Beyond pressure acid leaching the Chesbar option, Nikel/cobalt forum, Melboume,2003
- D. Anoyo, Atmospheric leach process for the recovery of nikel and cobalt from limonite and saprolite ores, US patent 2002041840, 2002

[/symple_box][symple_clear_floats]