Nghiên cứu khả năng hòa tách niken và đồng từ tinh quặng niken ôxit đã được hoàn nguyên sơ bộ trong dung môi amôni
06/12/2017
Bài báo giới thiệu các kết quả thử nghiệm ứng dụng các hợp chất chứa amôni để hoà tách niken và đồng từ tinh quặng niken Việt nam tại Phòng Công nghệ kim loại, Viện Khoa học vật liệu.
A study on disolving process of nickel and copper from preliminary reduced nickel oxite concentrates in ammoniacal media
Phạm Đức Thắng Viện Khoa học vật liệu, Viện Khoa học và công nghệ Việt Nam
1. Đặt vấn đề
Một số hợp chất amôni khi tan trong nước tạo nên dung môi có thể hoà tan nhiều kim loại khác nhau. Đối với các hợp chất chứa chủ yếu sắt, niken và đồng thì dung môi amôni hoà tan chọn lọc hai nguyên tố sau. Còn sắt ở môi trường dung dịch có độ pH cao hơn 7,5 và giàu ôxy thì hầu như không bị hoà tan. Do đó có thể sử dụng dung môi amôni để hoà tách một số nguyên tố mong muốn, cụ thể là niken và đồng mà không sợ có sắt bị hoà tan lẫn vào. Đã có một số công trình nghiên cứu sử dụng phương pháp này để tách chiết chúng từ các hợp chất rắn khác nhau của chúng [1,2,3]. Bài báo giới thiệu các kết quả thử nghiệm ứng dụng các hợp chất chứa amôni để hoà tách niken và đồng từ tinh quặng niken Việt nam tại Phòng Công nghệ kim loại, Viện Khoa học vật liệu. Dưới đây trình bầy một số quá trình mới hoà tách niken trong dung môi amôni
1.1. Hoàn nguyên tinh quặng niken
Mục đích của công đoạn hoàn nguyên tinh quặng là đưa niken trong quặng từ dạng ôxit thành niken kim loại. Khi nung hoàn nguyên ở nhiệt độ cao sẽ xảy ra các phản ứng sau [4]:
2C + O2 → 2CO NiO + CO → Ni + CO2 CO2 + C → CO CO + 3Fe2O3 → 2Fe3O4 + CO2 4CO + Fe3O4 → 3Fe + 4CO2 Cu2O + CO → 2Cu + CO2
Niken và sắt được hoàn nguyên thành các hạt mixmetal để có thể hoà tan được trong các dung môi khác nhau thuộc hệ amôni.
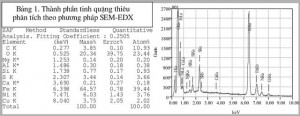
Bảng 1
1.2. Quá trình thuỷ luyện trong dung môi amôni theo nguyên tắc Becher
Trong dung môi amôni kim loại niken và sắt có thể hoà tan theo nguyên tắc Becher mà tác giả [5] đã đề cập. Theo đó, khi đưa tinh quặng đã hoàn nguyên vào dung dịch điện giải [dung dịch (NH4)2CO3], thì trên bề mặt của các hạt tinh quặng xuất hiện một cách tự nhiên vô vàn các cặp vi pin gây ăn mòn mà cực dương là sắt và niken kim loại, cực âm là tổ hợp hêmatit (Fe2O3) và manhetit (Fe3O4). Trên anôt và catôt xảy ra các phản ứng điện hoá sau [5]:
Tại anốt (FeNi- kamacite) :
Ni(kimloại) – 2e → Ni 2+ (1) Fe(kimloại) – 2e → Fe2+ (2)
Tại catôt (Fe2O3 , Fe3O4) :
O2 + 2H2O + 4e → 4(OH) - (3)
Đối với niken kim loại xảy ra phản ứng tạo phức như sau:
Ni + 3(NH4)2CO3 + 1/2O2 → [Ni(NH3)6]CO3 + 2CO2 + 3H2O (4)
Đối với sắt kim loại, xảy ra phản ứng tạo phức và thuỷ phân như sau :
Fe + 3(NH4)2CO3 + 1/2O2 → [Fe(NH3)6]CO3 + 2CO2 + 3H2O (5) [Fe(NH3)6]CO3 + H2O → Fe(OH)2 + 6NH3 + CO2 (6)
Tổng của 2 phản ứng (5) và (6) liên quan đến sắt trên sẽ là :
Fe + 3(NH4)2CO3 + 1/2O2 → Fe(OH)2 + 6NH3 + 3CO2 + 2H2O (7)
Phản ứng tổng hoà tan tinh quặng (4)+(7) sẽ là:
FeNi + 6(NH4)2CO3 + O2 → [Ni(NH3)6]CO3 + Fe(OH)2 + 6NH3 + 5CO2 + 5H2O (8)
Theo tài liệu [2] thì Kamacite FeNi còn có thể hoà tan trong dung môi NH3 theo phản ứng có phần ngược lại với (8) như sau :
FeNi + O2 + 8NH3 + 3CO2 + H2O → Ni(NH3)6CO3 + FeCO3 + (NH4)2CO3 (9)
Để ý rằng về thực chất, hai hợp chất amôni (NH4)2CO3 và NH3 khi hoà tan trong nước đều có thể chuyển hoá trở thành nhau theo phản ứng [4]:
(NH4)2CO3 → 2NH3 + CO2 + H2O (10)
Do đó không thể coi các phản ứng (8) hay (9) có thể kết thúc một cách trọn vẹn và triệt để. Nếu quá trình hoà tách xảy ra trong buồng kín, các sản phẩm thứ cấp như (NH4)2CO3 hoặc NH3 + CO2 được phát sinh với nồng độ dủ lớn thì chúng lại tiếp tục tham gia vào phản ứng hoà tan kamacite khi có dư nồng độ ôxy. Vậy phương trình phản ứng triệt để cần phải được triển khai từ các phản ứng (8) và (9) như sau :
Để ý rằng nếu nhân hai vế của (9) với 6 rồi cộng với (8) ta sẽ thu được tổng :
7FeNi + 7O2 + 42NH3 + 13CO2 + H2O → 7Ni(NH3)6CO3 + 6FeCO3 + Fe(OH)2 (11)
Hoặc nếu nhân 2 vế của của (8) với 4 và 2 vế của (9) với 3 rồi cộng với nhau ta sẽ thu được tổng theo kiểu khác :
7FeNi + 21(NH4)2CO3 + 7O2 → 7[Ni(NH3)6]CO3 + 4Fe(OH)2 + 3FeCO3 + 11CO2 + 17H2O (12)
Rõ ràng 2 phương trình phản ứng (11) và (12) mới có thể được coi là phản ứng triệt để. Tuy nhiên điều này chắc chắn khó thực hiện được vì thực tế sự thất thoát khí NH3 thứ cấp được tạo thành như là một sản phẩm trung gian hoặc do sự phân huỷ của (NH4)2CO3 thứ cấp là điều không thể tránh khỏi, dẫn đến sự mất cân bằng về nồng độ của các chất tham gia phản ứng. Đây chính là điều còn bàn cãi và cần có sự đầu tư nghiên cứu sâu để làm sáng tỏ quá trình ăn mòn điện hoá đã nêu ở trên. Dung dịch hoà tách được gia nhiệt bằng các biện pháp khác nhau để thuỷ phân amoniacad thành cacbonat bazơ niken và đồng theo phản ứng [2]:
5Ni(NH3)6CO3 + 3H2O → 2NiCO3.3Ni(OH)2 + 30NH3 + 3CO2 (13)
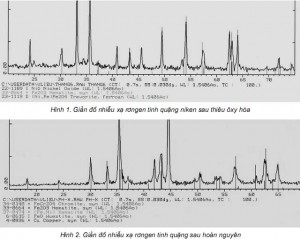
Dễ dàng nhận thấy rằng 2 hợp chất sản phẩm của phản ứng (13) là 30NH3 + 3CO2 có thể được thu hồi để phục vụ cho quá trình hoà tách niken theo phản ứng (9) đã nêu. 2. Thực nghiệm Đối tượng nghiên cứu là tinh quặng sau thiêu ôxy hoá có thành phần và cấu trúc pha nêu trên bảng 1 (Phân tích tại Trung tâm COMFA - Viện Khoa học vật liệu) và hình 1 (Phân tích tại Viện KHVL). Tinh quặng này được trộn với bột cacbon (than đá, than củi, than cốc), sau đó nung hỗn hợp này trong hộp kín ở nhiệt độ trên 1100°C. Trên giản đồ nhiễu xạ của tinh quặng sau thiêu oxy hoá ở hình 1, niken nằm trong 2 pha là NiO và pha oxyt đa kim (Ni,Fe)Fe2O4.
Hình 1 và 2
Kết quả phân tích tinh quặng sau thiêu ôxy hoá và sau hoàn nguyên cho thấy các sản phẩm hoàn nguyên trùng khớp với các sản phẩm của các phản ứng nêu ở mục 1.1. Bột kim loại niken và sắt sau khi được hoàn nguyên sẽ kết với nhau thành mixmetal ở dạng kamacite (xem hình 2).
Tinh quặng sau hoàn nguyên sơ bộ có thành phần pha như đã nêu trên được cho vào dung môi amôni cacbonat với nồng độ theo giả định hoà tan hết hỗn hợp FeNi chiếm 10% trong 1000g tinh quặng là 2.6 mol (NH4)2CO3 + 2mol O2. Tức là để hoà tan hết 1000g tinh quặng sau hoàn nguyên cần 250g (NH4)2CO3 + 32g O2.
Quá trình hoà tách được thực hiện một lần với sự khuấy trộn liên tục trong 6h với tốc độ 200-250 vòng/phút, dung dịch hoà tách được gia nhiệt và duy trì ở nhiệt độ (60÷70) °C. Amôni cacbonat được cung cấp theo 3 phương án: cung cấp toàn bộ lượng dung môi amôni một lần; cung cấp một nửa lượng dung môi amôni ngay khi bắt đầu hoà tách và dẫn truyền từ từ (theo kiểu truyền huyết thanh) lượng dung môi còn lại cho đến khi kết thúc hoà tách; cung cấp dần dần theo kiểu truyền dẫn huyết thanh (nhỏ giọt hoặc dòng nhỏ).
Các quá trình này sẽ diễn ra trong khoảng thời gian 6h. Riêng ôxy được cung cấp bởi hyđrô perôxyt H2O2 theo một biện pháp dẫn truyền dần dần cho cả 3 phương án với tính toán như sau: truyền một nửa lượng peroxyt trong 2h đầu tiên, còn lại truyền tiếp trong 4h sau đó. Biện pháp dẫn truyền là để bảo đảm phản ứng xảy ra tương đối triệt để và hạn chế tối đa sự bay hơi của oxy và hợp chất amôniac là sản phẩm trung gian, được tạo thành trong quá trình phản ứng.
3. Kết quả và thảo luận
Dung dịch sau mỗi đợt hoà tách được phân tích theo phương pháp khối phổ plasma cảm ứng ICP- AES model 7500a tại Viện Công nghệ xạ hiếm. Từ kết quả phân tích ICP có thể tính toán được lượng niken và đồng thu hồi.
| Tỷ lệ thu hồi niken sau hoà tách q, % | ||||||
| TT | Phương án cấp dung môi | Thời gian hoà tách , h | ||||
| 0,5 | 1,5 | 3 | 4,.5 | 6 | ||
| 1 | Cấp toàn bộ 1 lần | 35,17 | 43,41 | 46,84 | 48,73 | 49,44 |
| 2 | Cấp dần một phần | 31,05 | 46,73 | 56,01 | 61,88 | 63,03 |
| 3 | Cấp dần toàn bộ | 10,03 | 28,92 | 55,83 | 62,02 | 62,66 |
Bảng 2. Tỷ lệ thu hồi niken bằng dung môi amôni cacbonat phụ thuộc vào thời gian hoà tách và biện pháp cấp dung môi amôni
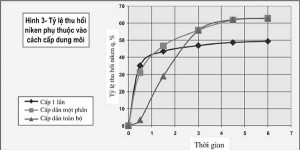
Hình 3
Kết quả thu hồi được đưa vào bảng 2 và được biểu diễn bằng đồ thị ở hình 3. Căn cứ vào bảng 2 và các đồ thị được biểu diễn trên hình 3 thấy rằng ở hai trường hợp đầu tốc độ hoà tách tăng nhanh theo quy luật tuyến tính. Nhưng ở trường hợp 1 quy luật này chỉ duy trì trong khoảng thời gian ban đầu từ 0 đến 1h liên quan đến việc chất dung môi amôni được cấp đầy đủ 1 lần ngay từ đầu khiến phản ứng hoà tách xảy ra rất mãnh liệt.
Tuy nhiên kèm theo đó, các sản phẩm khí NH3 trung gian cũng được hình thành ồ ạt, một phần của chúng vẫn tiếp tục tham gia phản ứng và một phần không nhỏ bốc hơi thoát ra ngoài, dẫn đến hàm lượng của chất dung môi bị hao hụt nhanh chóng và khiến cho tốc độ phản ứng chậm dần. Đó là lý do vì sao sau 2h, phản ứng hoà tách gần như bị khống chế và đường cong biểu diễn quá trình này đạt tiệm cận ở mức xấp xỉ 50%. ở trường hợp 2, do dung môi được cấp có thể coi là đủ để phản ứng xảy ra gẩn như triệt để và quy luật tuyến tính được duy trì gần giống với trường hợp 1 trong thời gian 1h đầu tiên. Sau đó phần dung môi còn lại được cấp dần, tránh được hiện tượng thất thoát ồ ạt sản phẩm thứ cấp NH3.
Nhờ duy trì được nồng độ dung môi ở một mức cao hơn so với trường hợp 1 nên quá trình hoà tách vẫn tiếp tục diễn ra nhưng quy luật tuyến tính dần dần bị mất và đồ thị từ đó về sau là đường cong có xu hướng tiệm cận với giá trị ổn định q = 63%. Tỷ lệ thu hồi niken trong trường hợp này cao hơn trường hợp đầu gấp 1,25 lần.
Còn ở trường hợp 3, do trong khoảng thời gian đầu tiên, nồng độ dung môi còn quá thấp nên phản ứng xảy ra chậm và đồ thị là đường thẳng (tuyến tính) với góc nghiêng rất thấp. Sau một thời gian cấp dần (sau khoảng 0,5h) nồng độ dung môi có thể đã đủ lớn để phản ứng xảy ra nhanh hơn và đồ thị là đường thẳng với góc nghiêng lớn hơn được duy trì trong khoảng thời gian từ 0,5 đến 3h. Sau đó quá trình hoà tách bị chậm lại giống như ở trường hợp 2 đã nêu ở trên. Có thể thấy rằng hiệu quả hoà tách theo phương án 1 tương đối thấp (chỉ đạt 50%).
Còn theo phương án 2 và 3 tỷ lệ thu hồi tối đa niken đạt mức xấp xỉ 63%. Các nguyên nhân khiến phản ứng hoà tách sau một thời gian nhất định bị ức chế có thể là do ảnh hưởng của các tác nhân như: kích thước hạt tinh quặng, mức độ hoàn nguyên tinh quặng, mức độ bão hoà của ion niken đã được hoà tan, hoặc trên bề mặt các hạt kim loại xuất hiện màng thụ động...
| No | Elements | Content, mg/l | No | Elements | Content, mg/l |
| 1 | Na | 16,167 | 13 | Zn | 15,44 |
| 2 | Mg | 6,293 | 14 | Ga | 0,016 |
| 3 | K | 10,507 | 15 | Se | 0,238 |
| 4 | Ca | 9,273 | 16 | Rb | 0,056 |
| 5 | Sc | 0,002 | 17 | Sr | 0,071 |
| 6 | Ti | 0,030 | 18 | Mo | 0,482 |
| 7 | Cr | 0,205 | 19 | Ag | 0,001 |
| 8 | Mn | 0,143 | 20 | Cd | 0,004 |
| 9 | Fe | 6,92 | 21 | Sb | 0,024 |
| 10 | Co | 2,67 | 22 | W | 0,029 |
| 11 | Ni | 3444,4 | 23 | Pb | 0,067 |
| 12 | Cu | 564,41 | 24 | U | 0,005 |
Bảng 3. Thành phần dung dịch hoà tách theo phương án cấp dần dung môi amôni
Đây là các vấn đề còn cần phải tiếp tục đầu tư nghiên cứu chuyên sâu để làm sáng tỏ hơn nữa cơ chế hoà tan của các hạt mixmetal trong tinh quặng. Dung dịch hoà tách sau khi loại bỏ cặn được giới thiệu ở hình 4 với thành phần các nguyên tố ở bảng 3. Căn cứ vào kết quả phân tích bằng phương pháp ICP-MS nêu trên bảng 3 thì dung dịch hoà tách với hàm lượng niken > 3 g/lit được coi là đạt yêu cầu để sử dụng làm nguyên liệu cho quá trình điều chế tiếp các hợp chất chứa niken tiếp theo, được thực hiện theo phản ứng 13.
Hình 4. Mẫu dung dịch hoà tách bằng dung môi amôni
4. Kết luận
- Có thể hoà tách niken và đồng bằng dung môi amôni. Phương pháp này cho phép thu được các phức chất amoniacad đồng và niken với độ sạch tương đối cao, đạt trên 99,8% (bảng 3).
- Quá trình hoà tách thí nghiệm theo các phương án cấp dung môi khác nhau sẽ cho hiệu suất thu hồi niken khác nhau. Trong đó các phương án cấp dần dung môi cho hiệu suất thu hồi niken cao nhất, có thể thu hồi đạt tới 63% niken từ tinh quặng niken oxit sau hoàn nguyên sơ bộ.
- Như vậy để thu hồi được toàn bộ niken và đồng cần phải hoà tách lặp lại vài lần theo các phương án cấp dần dung môi. Hiện nay Viện Khoa học vật liệu đang tiếp tục hoàn thiện phương pháp hoà tách này để có thể áp dụng vào thực tiễn sản xuất trong thời gian tới.
[symple_box color="yellow" text_align="left" width="100%" float="none"]
Tài Liệu Tham Khảo
- J.E.Silva, D.Soares et all. Leaching behaviour of a galvanic sludge in sulfuric acid and ammoniacal media, Journal of Hazardous material, B121, 2005
- F. Kadlec a kol, Vyroba nezelezných kovu. SNTL, Praha 1971
- Phạm Đức Thắng, Nghiên cứu thử nghiệm công nghệ chế tạo niken kim loại từ tinh quặng niken Bản Phúc – Sơn la, Báo cáo tổng kết đề tài KHCN cấp Viện KHVL, Hà Nội, 2009
- Hoàng Nhâm, Hoá vô cơ, T2-3, NXB Giáo dục, 1999
- Đoàn Đình Phương, Phạm Đức Thắng và cộng tác viên. Về khả năng chế biến quặng ilmenit đồng thời thành rutin nhân tạo và bột mầu sắt đỏ,TC Kim loại, số 18, tháng 6/2008 (Số kỷ niệm 15 năm thành lập Viện khoa học vật liệu)
[/symple_box][symple_clear_floats]