Giản đồ trạng thái E-pH hệ Ni-S-H2O trong điện phân sunfit niken
25/12/2017
Với giản đồ trạng thái cân bằng E-pH xác lập được, đã làm sáng tỏ cơ chế và điều kiện hòa tan sunfit kim loại thành ion kim loại và S nguyên tố...
E-pH state diagram of Ni-S-H2O system in electrolytic nickel sulphide
NGUYỄN KIM THIẾT, ĐINH TIẾN THỊNH Trường Đại Học Bách Khoa Hà Nội
Ngày nhận bài: 14/1/2016, Ngày duyệt đăng: 21/3/2016
TÓM TẮT
Bằng việc xác lập giản đồ trạng thái cân bằng E-pH hệ Ni-S-H2O đã đưa ra 2 khả năng hòa tan điện hóa Ni3S2 khi điện phân tinh luyện Ni với anot sufit Ni: khả năng hòa tan gián tiếp Ni3S2 qua trung gian NiS rồi từ NiS thành Ni2+ và khả năng hòa tan trực tiếp Ni3S2 thành Ni2+. Với giản đồ trạng thái cân bằng E-pH xác lập được, đã làm sáng tỏ cơ chế và điều kiện hòa tan sunfit kim loại thành ion kim loại và S nguyên tố. Từ khóa: điện phân niken, hòa tan Ni3S2ABSTRACT ABST
By establishing the equilibrium E-pH diagram of Ni-S-H2O system, it has been shown 2 possibilities for elec- trochemical dissolution Ni3S2 when electrolytic refining Ni with the anode sunfide Ni: dissolving indirectly from Ni3S2 through NiS then ion Ni2+ and dissolving directly from Ni3S2 to ion Ni2+. With the established equilibrium E- pH diagram, it has been clarified the mechanism and condition for dissolving a metal sulphides into metal ions and S elemental. Keywords: electrolytic nickel, dissolving Ni3S2 1. Đặt vấn đề Hiện nay trong điện phân tinh luyện niken, xu thế phát triển theo hướng điện phân trực tiếp anot sunfit Ni (faisten) [1]. Công nghệ này bỏ qua được các công đoạn hỏa luyện phức tạp và tốn kém như thiêu oxy hóa, hoàn nguyên thiêu phẩm thành niken thô. Đặc biệt của công nghệ tiên tiến này là người ta có thể lấy trực tiếp niken sạch và lưu huỳnh dạng nguyên tố. Nghiên cứu này muốn thông qua việc xác lập giản đồ trạng thái cân bằng E-pH hệ 4 nguyên Ni-S-H2O (Ni-S-H-O) giải thích cơ chế của quá trình điện phân trực tiếp từ sunfit Ni. 2. Thiết lập giản đồ E-pH hệ Ni-S-H2O 2.1. Dữ liệu và tính toán nhiệt động học các phản ứng Giản đồ E-pH hệ Ni-S-H2O được xác lập bằng phần mềm vẽ giản đồ E-pH [2] dựa trên nguyên lý của Pourbaix [3]. Các dữ liệu nhiệt động học dùng trong tính toán được ghi trong bảng 1. Dữ liệu của các chất khác được sử dụng trong atlas của Pourbaix [3]. Các phản ứng điện hóa xảy ra trong hệ đã thể hiện trên các giản đồ trạng thái cân bằng E-pH (hình 1, 2 và 3) cùng với giá trị E, pH của chúng được đánh số như sau:1. Ni++ + H2O = NiO + 2H+ pH = 6,0586 + lgC
2. 3Ni+++ 4H2O = Ni3O4 + 8H+ + 2e E= 1,978 - 0,236pH + 0,0296lgC
3. Ni++ + 2H2O = NiO2 + 4H+ + 2e E= 1,594 - 0,118pH + 0,0296lgC
Bảng 1. Dữ liệu nhiệt động học của các chất ưu tiên tồn tại trong h
| Các chất | ΔG0 298 (J/mol) | ΔG0 298 (cal/mol) | Tài liệu tham khảo |
| NiO Ni3O4 NiO2 NiS Ni3S2 Ni2H | -211 710 -711 908 -215 141 -79 496 -197 066 -11 800 | -50 600 -170 150 -51 420 -19 000 -47 100 -2 820 | [4] [5] [4] [5] [4] [5] [4] [5] [4] [5] [6] |
4. Ni3O4 + 2H2O = 3NiO2 + 4H+ + 4e E= 1,402 - 0,059pH + 0,0148lgC
5. 3NiO + H2O = Ni3O4 + 2H+ + 2e E= 0,903 - 0,059pH + 0,0296lgC
6. Ni3S2 + 11H2O = 3NiO + 2SO42- + 22H+ + 18e E= 0,388 - 0,072pH + 0,0033lgC
7. Ni2H = 2Ni++ + H+ + 5e E= -0,224 - 0,012pH + 0,0118lgC
8. 3Ni2H + 4H2S.dd = 2Ni3S2 + 11H+ + 11e E= -0,302 - 0,059pH + 0,0054lgC
9. 3Ni2H + 4HS- = 2Ni3S2 + 7H+ + 11e E= -0,452 - 0,038pH + 0,0054lgC
10. 3Ni2H + 4S2- = 2Ni3S2 + 3H+ + 11e E= -0,751 - 0,016pH + 0.0054lgC
11. Ni2H = 2Ni + H+ + e E= -0.122 - 0,059pH + 0,0591lgC
12. 3Ni + 2S2- = Ni3S2 + 4e E= -0,987 + 0,0148lgC
13. Ni3S2 + 4H+ = 3Ni++ + 2H2S.dd + 2e E= -0,012 + 0,118pH + 0,0296lgC
14. Ni3S2 + H2S.dd = 3NiS + 2H+ + 2e E= -0,073 - 0,059pH + 0,0296lgC
15. Ni3S2 + HS- = 3NiS + H+ + 2e E= -0,280 - 0,030pH + 0,0296lgC
16. 3NiS + 4H2O = Ni3S2 + SO42- + 8H+ + 6e E= 0,429 - 0,079pH + 0,0098lgC
17. S + 4H2O = HSO4- + 7H+ + 6e E= 0,338 - 0,069pH + 0,0098lgC
18. H2S.dd = S + 2H+ + 2e E= 0,142 - 0,059pH + 0,0296lgC
19. S + 4H2O = SO42- + 8H+ + 6e E= 0,357 - 0,079pH + 0,0098lgC
20. Ni++ + H2S.dd = NiS + 2H+ pH= -0,3411 + lgC
21. NiS = Ni++ + S + 2e E= 0,162 + 0,0296lgC
22. NiS + 4H2O = Ni++ + SO42- + 8H+ + 8e E= 0,308 - 0,059pH + 0,0074lgC
23. H2 = 2H+ + 2e E= 0,000 - 0,059pH + 0,0296lgC
24. 2H2O = O2 + 4H+ + 4e E= 1,229 - 0,059pH + 0,0148lgC
25. Ni3S2 = 3Ni++ + 2S + 6e E= 0,090 + 0,0098lgC
26. Ni3S2 + 8H2O = 3Ni++ + 2SO42- + 16H+ + 18e E= 0,268 - 0,053pH + 0,0033lgC
27. Ni = Ni++ + 2e E= -0,250 + 0,0296lgC
28. Ni + H2O = NiO + 2H+ + 2e E= 0,108 - 0,059pH + 0,0296lgC
2.2. Giản đồ trạng thái cân bằng E-pH
Dựa trên kết quả tính toán các phản ứng điện hóa, dùng phần mềm [2] sẽ vẽ được giản đồ cân bằng E-pH hệ Ni-S-H2O như trên hình 1. [caption id="attachment_1810" align="aligncenter" width="300"]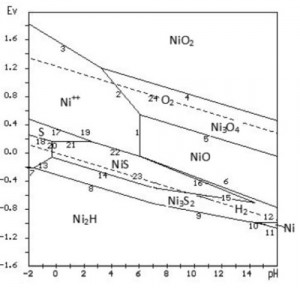 Hình 1. Giản đồ cân bằng E-pH hệ Ni-S-H2O ở 25 oC, 1 at[/caption]
Các con số ghi bên cạnh các đường phân chia miền ưu tiên tồn tại của các chất chính là số thứ tự các phản ứng điện hóa đã nêu ở trên. Giản đồ phân chia miền ưu tiên tồn tại của các cấu tử như sau:
- Trong môi trường hoàn nguyên (E thấp), hydrit niken Ni2H ưu tiên tồn tại ở phía dưới các đường 7, 8, 9, 10 và 11. Niken kim loại chỉ có thể tồn tại ở 1 miền rất nhỏ không mang ý nghĩa về mặt công nghệ khi pH > 14, được giới hạn bởi đường 11, 12 và trục tọa độ.
- Tiếp giáp với miền Ni2H và Ni là miền tồn tại của Ni3S2.
- Tiếp theo là miền ưu tiên tồn tại của NiS. Miền này nằm ở phía trên và luồn sâu vào miền Ni3S2 ở phía bên phải (phía pH tăng) và giới hạn bởi các đường 14, 15, 16, 22, 21 và đường 20.
- Pha NiO tạo thành do oxy hóa Ni3S2 tồn tại trong miền giới hạn bởi các đường số 6, 1, 5 và trục tọa độ. Miền tồn tại của Ni3O4 nằm kề trên miền tồn tại của NiO và giới hạn bởi đường 5, 2, 4 và trục tọa độ. Miền tồn tại của NiO2 giới hạn bởi đường 3, 4 và các trục tọa độ.
- Trong hệ, Ni sunfit và sunfua tan ra tồn tại dưới dạng ion Ni2+ nằm trong miền giới hạn bởi trục tọa độ và các đường số 7, 13, 20, 21, 22, 1, 2 và 3.
- Lưu huỳnh nguyên tố cùng tồn tại với ion Ni2+ trong miền giới hạn bởi các đường 18, 21, 19, 17 và trục tọa độ.
[caption id="attachment_1815" align="aligncenter" width="300"]
Hình 1. Giản đồ cân bằng E-pH hệ Ni-S-H2O ở 25 oC, 1 at[/caption]
Các con số ghi bên cạnh các đường phân chia miền ưu tiên tồn tại của các chất chính là số thứ tự các phản ứng điện hóa đã nêu ở trên. Giản đồ phân chia miền ưu tiên tồn tại của các cấu tử như sau:
- Trong môi trường hoàn nguyên (E thấp), hydrit niken Ni2H ưu tiên tồn tại ở phía dưới các đường 7, 8, 9, 10 và 11. Niken kim loại chỉ có thể tồn tại ở 1 miền rất nhỏ không mang ý nghĩa về mặt công nghệ khi pH > 14, được giới hạn bởi đường 11, 12 và trục tọa độ.
- Tiếp giáp với miền Ni2H và Ni là miền tồn tại của Ni3S2.
- Tiếp theo là miền ưu tiên tồn tại của NiS. Miền này nằm ở phía trên và luồn sâu vào miền Ni3S2 ở phía bên phải (phía pH tăng) và giới hạn bởi các đường 14, 15, 16, 22, 21 và đường 20.
- Pha NiO tạo thành do oxy hóa Ni3S2 tồn tại trong miền giới hạn bởi các đường số 6, 1, 5 và trục tọa độ. Miền tồn tại của Ni3O4 nằm kề trên miền tồn tại của NiO và giới hạn bởi đường 5, 2, 4 và trục tọa độ. Miền tồn tại của NiO2 giới hạn bởi đường 3, 4 và các trục tọa độ.
- Trong hệ, Ni sunfit và sunfua tan ra tồn tại dưới dạng ion Ni2+ nằm trong miền giới hạn bởi trục tọa độ và các đường số 7, 13, 20, 21, 22, 1, 2 và 3.
- Lưu huỳnh nguyên tố cùng tồn tại với ion Ni2+ trong miền giới hạn bởi các đường 18, 21, 19, 17 và trục tọa độ.
[caption id="attachment_1815" align="aligncenter" width="300"]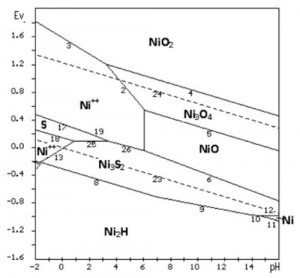 Hình 2. Giản đồ E-pH hệ Ni-S-H2O hòa tan trực tiếp Ni3S2 ở 25 oC, 1 at[/caption]
[caption id="attachment_1816" align="aligncenter" width="300"]
Hình 2. Giản đồ E-pH hệ Ni-S-H2O hòa tan trực tiếp Ni3S2 ở 25 oC, 1 at[/caption]
[caption id="attachment_1816" align="aligncenter" width="300"]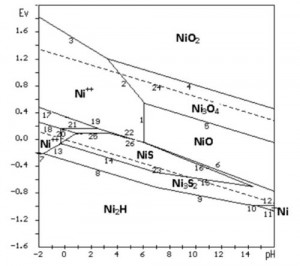 Hình 3. Giản đồ E-pH hệ Ni-S-H2O hỗn hợp ở 25 oC, 1 at[/caption]
3. Thảo luận kết quả
3.1. Quá trình anot
Hòa tan điện hóa gián tiếp Ni3S2
Nhìn vào hình 1 thấy rõ, khi cho vào hệ thống một thế điện cực lớn hơn -0,22 V (phía trên đường số 7) với pH từ -1,63 đến -0,34 (miền bên trái đường 13), Ni3S2 (faisten Ni) bị hòa tan trực tiếp thành Ni2+ theo phản ứng 13 nhưng miền này nồng độ axit rất cao nên không có ý nghĩa mấy trong thực tiễn điện phân tinh luyện niken. Trong khoảng pH từ -0,34 đến < 6, khi tăng điện thế E, với trạng thái cân bằng điện hóa, Ni3S2 bị oxy hóa tạo NiS theo phản ứng số 14. Khi điện thế E tiếp tục tăng lên, theo chiều tăng của pH, NiS tan ra tạo Ni2+ lần lượt theo các phản ứng 20, 21, 22 (hình 1). ở đây đặc biệt lưu ý đến phản ứng số 21.
Đường biểu diễn của phản ứng này cắt ngang qua miền ưu tiên tồn tại của lưu huỳnh nguyên tố. Đây chính là cơ chế hòa tan của một sunfit hay sunfua thành ion kim loại và lưu huỳnh nguyên tố. Việc tạo ra lưu huỳnh nguyên tố chỉ xảy ra trong khoảng pH nhất định.
Cơ chế hòa tan sunfit Ni (faisten Ni) từ Ni3S2 thành Ni2+ qua chất trung gian NiS vừa trình bày gọi là cơ chế hòa tan gián tiếp. Quá trình hòa tan gián tiếp áp dụng cho quá trình điện hóa xảy ra trong điều kiện cân bằng điện hóa.
Hòa tan trực tiếp Ni3S2
Trong thực tế, quá trình khó đạt tới cân bằng. Khi đó Ni3S2 có thể hòa tan trực tiếp theo các phản ứng điện hóa 13, 25, 26 (hình 2). Đường giới hạn của miền NiS hòa tan tạo ra Ni2+ và S nguyên tốlà đường 25. Ni3S2 hòa tan trực tiếp thành S có E nhỏ hơn (0,09 V so với 0,162 V của NiS). Nói một cách khác, Ni3S2 hòa tan trực tiếp thuận lợi hơn NiS. Không những vậy, vùng pH để hòa tan điện hóa trực tiếp Ni3S2 cũng dịch chuyển về phía pH lớn hơn so với hòa tan gián tiếp qua NiS (pH = 0,86 ÷ 3,38 so với -0,34 ÷ 2,5).
Để tiện so sánh, hãy xem giản đồ E-pH tổng hợp cả 2 trường hợp trong cùng một giản đồ trên hình 3.
Kết quả nghiên cứu này chỉ hoàn toàn dựa trên số liệu nhiệt động học. Ni3S2 hòa tan điện hóa thực tế theo cơ chế nào cần được kiểm chứng qua thực nghiệm.
3.2. Quá trình catot
Trong giản đồ trạng thái cân bằng E-pH hệ Ni- S-H2O, Ni hầu như chỉ tồn tại dưới dạng Ni2H (hình 1, 2). Thực tế cho thấy, quá trình catot xảy ra không thuận nghịch, nghĩa là không xảy ra theo giản đồ cân bằng E-pH hệ Ni-S-H2O như hình 1. Ví dụ phản ứng 13:
Hòa tan anot Ni3S2 + 4H+ = 3Ni2+ + 2H2S.dd + 2e (chiều thuận)
Kết tủa catot 3Ni2+ + 2H2S.dd + 2e = Ni3S2 + 4H+ (chiều nghịch)
Tức là Ni2+ không thể tác dụng với H2S.dd để tạo Ni3S2 (theo chiều nghịch của phản ứng 13) dù rằng điện thế điện cực Ni3S2/Ni2+ (E = -0.012 V) dương hơn thế điện cực Ni/Ni2+ (E = -0.25 V) mà Ni2+ phóng điện tạo Ni (theo chiều nghịch của phản ứng 27). Cho nên quá trình catot sẽ được giải thích theo giản đồ E-pH của hệ Ni-H2O trình bày trong hình 4. Từ đây thấy rõ, nếu điện phân ở pH = 2 và nhỏ hơn 2, Ni sẽ kết tủa dưới dạng Ni2H. Kim loại Ni không có H2 chỉ có thể lấy được trong điều kiện điện phân ở pH = 2,5 - 6.
[caption id="attachment_1817" align="aligncenter" width="300"]
Hình 3. Giản đồ E-pH hệ Ni-S-H2O hỗn hợp ở 25 oC, 1 at[/caption]
3. Thảo luận kết quả
3.1. Quá trình anot
Hòa tan điện hóa gián tiếp Ni3S2
Nhìn vào hình 1 thấy rõ, khi cho vào hệ thống một thế điện cực lớn hơn -0,22 V (phía trên đường số 7) với pH từ -1,63 đến -0,34 (miền bên trái đường 13), Ni3S2 (faisten Ni) bị hòa tan trực tiếp thành Ni2+ theo phản ứng 13 nhưng miền này nồng độ axit rất cao nên không có ý nghĩa mấy trong thực tiễn điện phân tinh luyện niken. Trong khoảng pH từ -0,34 đến < 6, khi tăng điện thế E, với trạng thái cân bằng điện hóa, Ni3S2 bị oxy hóa tạo NiS theo phản ứng số 14. Khi điện thế E tiếp tục tăng lên, theo chiều tăng của pH, NiS tan ra tạo Ni2+ lần lượt theo các phản ứng 20, 21, 22 (hình 1). ở đây đặc biệt lưu ý đến phản ứng số 21.
Đường biểu diễn của phản ứng này cắt ngang qua miền ưu tiên tồn tại của lưu huỳnh nguyên tố. Đây chính là cơ chế hòa tan của một sunfit hay sunfua thành ion kim loại và lưu huỳnh nguyên tố. Việc tạo ra lưu huỳnh nguyên tố chỉ xảy ra trong khoảng pH nhất định.
Cơ chế hòa tan sunfit Ni (faisten Ni) từ Ni3S2 thành Ni2+ qua chất trung gian NiS vừa trình bày gọi là cơ chế hòa tan gián tiếp. Quá trình hòa tan gián tiếp áp dụng cho quá trình điện hóa xảy ra trong điều kiện cân bằng điện hóa.
Hòa tan trực tiếp Ni3S2
Trong thực tế, quá trình khó đạt tới cân bằng. Khi đó Ni3S2 có thể hòa tan trực tiếp theo các phản ứng điện hóa 13, 25, 26 (hình 2). Đường giới hạn của miền NiS hòa tan tạo ra Ni2+ và S nguyên tốlà đường 25. Ni3S2 hòa tan trực tiếp thành S có E nhỏ hơn (0,09 V so với 0,162 V của NiS). Nói một cách khác, Ni3S2 hòa tan trực tiếp thuận lợi hơn NiS. Không những vậy, vùng pH để hòa tan điện hóa trực tiếp Ni3S2 cũng dịch chuyển về phía pH lớn hơn so với hòa tan gián tiếp qua NiS (pH = 0,86 ÷ 3,38 so với -0,34 ÷ 2,5).
Để tiện so sánh, hãy xem giản đồ E-pH tổng hợp cả 2 trường hợp trong cùng một giản đồ trên hình 3.
Kết quả nghiên cứu này chỉ hoàn toàn dựa trên số liệu nhiệt động học. Ni3S2 hòa tan điện hóa thực tế theo cơ chế nào cần được kiểm chứng qua thực nghiệm.
3.2. Quá trình catot
Trong giản đồ trạng thái cân bằng E-pH hệ Ni- S-H2O, Ni hầu như chỉ tồn tại dưới dạng Ni2H (hình 1, 2). Thực tế cho thấy, quá trình catot xảy ra không thuận nghịch, nghĩa là không xảy ra theo giản đồ cân bằng E-pH hệ Ni-S-H2O như hình 1. Ví dụ phản ứng 13:
Hòa tan anot Ni3S2 + 4H+ = 3Ni2+ + 2H2S.dd + 2e (chiều thuận)
Kết tủa catot 3Ni2+ + 2H2S.dd + 2e = Ni3S2 + 4H+ (chiều nghịch)
Tức là Ni2+ không thể tác dụng với H2S.dd để tạo Ni3S2 (theo chiều nghịch của phản ứng 13) dù rằng điện thế điện cực Ni3S2/Ni2+ (E = -0.012 V) dương hơn thế điện cực Ni/Ni2+ (E = -0.25 V) mà Ni2+ phóng điện tạo Ni (theo chiều nghịch của phản ứng 27). Cho nên quá trình catot sẽ được giải thích theo giản đồ E-pH của hệ Ni-H2O trình bày trong hình 4. Từ đây thấy rõ, nếu điện phân ở pH = 2 và nhỏ hơn 2, Ni sẽ kết tủa dưới dạng Ni2H. Kim loại Ni không có H2 chỉ có thể lấy được trong điều kiện điện phân ở pH = 2,5 - 6.
[caption id="attachment_1817" align="aligncenter" width="300"]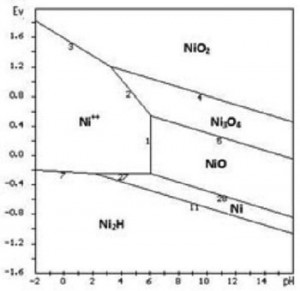 Hình 4. Giản đồ cân bằng E-pH hệ Ni-H2O[/caption]
Trong tài liệu [7] cho rằng, Ni và H2 cùng phóng điện trên cực âm và tạo thành dung dịch rắn đồng thời có tăng một chút các thông số mạng tinh thể. Lượng H2 sẽ bị phân hủy khi nung nóng và phân rã với tốc độ tối đa ở nhiệt độ 700 - 800 oC. Theo [7] thì Ni có thể hòa tan từ 200 đến 300 ml hydro. Nếu tính theo lý thuyết trong công thức Ni2H hàm lượng hydro là 0,845%, cao hơn số liệu đã công bố. Sự tồn tại của H2 trong Ni catot là đương nhiên nhưng là dung dịch rắn hay hợp chất hóa học Ni2H cũng cần phải được kiểm chứng bằng thực nghiệm.
4. Kết luận
1. Đã xác lập được giản đồ E-pH hệ Ni-S-H2O cho hai trường hợp: giản đồ cân bằng E-pH cho Ni3S2 hòa tan gián tiếp và trực tiếp thành Ni2+.
2. Qua các giản đồ được xác lập đã đề xuất:
- Cơ chế và điều kiện hòa tan Ni3S2 và NiS thành Ni2+ và S nguyên tố.
- Cơ chế và điều kiện hình thành Ni2H
Tài liệu trích dẫn
Hình 4. Giản đồ cân bằng E-pH hệ Ni-H2O[/caption]
Trong tài liệu [7] cho rằng, Ni và H2 cùng phóng điện trên cực âm và tạo thành dung dịch rắn đồng thời có tăng một chút các thông số mạng tinh thể. Lượng H2 sẽ bị phân hủy khi nung nóng và phân rã với tốc độ tối đa ở nhiệt độ 700 - 800 oC. Theo [7] thì Ni có thể hòa tan từ 200 đến 300 ml hydro. Nếu tính theo lý thuyết trong công thức Ni2H hàm lượng hydro là 0,845%, cao hơn số liệu đã công bố. Sự tồn tại của H2 trong Ni catot là đương nhiên nhưng là dung dịch rắn hay hợp chất hóa học Ni2H cũng cần phải được kiểm chứng bằng thực nghiệm.
4. Kết luận
1. Đã xác lập được giản đồ E-pH hệ Ni-S-H2O cho hai trường hợp: giản đồ cân bằng E-pH cho Ni3S2 hòa tan gián tiếp và trực tiếp thành Ni2+.
2. Qua các giản đồ được xác lập đã đề xuất:
- Cơ chế và điều kiện hòa tan Ni3S2 và NiS thành Ni2+ và S nguyên tố.
- Cơ chế và điều kiện hình thành Ni2H
Tài liệu trích dẫn
- Derek G. E. Kerfoot, Handbook of Extractive Metallurgy (Edited by Fathi Habashi), Tom 2, Nickel (12.1-12.15), Weinheim, New York, Chichester, Brisbana, Singapor, Toronto, WILEY-VCH ISBN 3-527-28792-2, 1997
- Nguyễn Kim Thiết, Phần mềm lập giản đồ E-pH. Tài liệu giảng dạy của Bộ môn vật liệu KLM & Compozit, 2000
- Pourbaix M, Atlas of electrochemical equilibra, Pergamon Press, 1966
- C.M. Chen, K. Aral, and G. J. Theus, EPRI, Report NP-3137, Vol. 2, Electric Power Research Institute, Palo Alto, CA, June 1983
- Philippe Marcus and Elie Protopopoff., J. Electrochem. Soc., Vol. 140, No. 6, June 1993, Potential pH Diagrams for Sulfur and Oxygen Adsorbed on Nickel in Water at 25 and 300 °C
- Baranowski, B., Bochéska, K, The Free Energy and Entropy of Formation of Nickel Hydride, Zeitschrift fỹr Physikalishe Chemie Neue Folge, 1965. Bd. 45, Heft 3 - 4, S. 140 - 152 (https://www.researchgate.net/publication/282440444)
- Ю. В. Баймаков, A. И. Журин, Электролиз в гидрометаллургическии, Москва “Металлургия” 1977.







