Giản đồ trạng thái cân bằng E-pH và ứng dụng trong điện phân thiếc
06/12/2017
Nghiên cứu này, đề cập đến ý nghĩa của các giản đồ trạng thái và cách xác lập các giản đồ trong quá trình điện phân tinh luyện thiếc.
Equilibrium state diagram E-pH and its application in Sn-electrorefining
Nguyễn Kim Thiết, Phạm Kim Đĩnh, Đinh Tiến Thịnh Đại học Bách khoa Hà Nội
Tóm tắt
Bằng phương pháp nghiên cứu lý thuyết trên giản đồ trạng thái cân bằng E-pH có thể tìm thấy các miền ưu tiên tồn tại của các cấu tử trong hệ dung dịch điện phân nói chung và trong hệ dung dịch điện phân Sn với các axit H2SO4, H2SiF6 nói riêng. So với các kim loại nặng khác như Cu và Pb, Sn rất dễ bị thủy phân ngay cả khi ở độ pH tương đối thấp, dẫn tới nguy cơ thụ động anôt rất cao.
Abstract
Based on study of the equilibrium state diagram E-pH we can find out existing zones of the constituents in elec- trolyze solutions in general and in the electrolyze solution of the tin with H2SO4, H2SiF6, in particulary. In compar- ison with other heavy metals such as Cu and Pb, the tin is easyly hydrolyzed even at low pH, that leads to very high anodic passivation.
1. Đặt vấn đề
Trong lý thuyết điện hoá, công thức Nernst về thế điện cực E của kim loại chỉ thể hiện được quan hệ:
E =E0 +RT/zF.lnC
mà không thể hiện được ảnh hưởng của pH. Quá trình điện cực xảy ra trong dung dịch nước nên giá trị pH có ý nghĩa rất quan trọng. Giản đồ trạng thái cân bằng E-pH do Pourbaix [1] xác lập (nên thường gọi là giản đồ Pourbaix) có thể mô tả được mối quan hệ của thế điện cực E của một kim loại với nồng độ iôn của nó và pH. Tất cả các quá trình hoá học và điện hoá được thể hiện qua các miền ưu tiên tồn tại và xu hướng dịch chuyển cân bằng của mỗi cấu tử trong hệ, tuỳ thuộc vào E, pH, Ci (hoạt độ) hoặc Pi (áp suất). Trong công trình của mình, Pourbaix đã trình bày các giản đồ cân bằng E-pH của hệ tất cả các nguyên tố với nước (hệ 3 nguyên) một cách chi tiết.
Trong thực tế luyện kim, các dung môi thường dùng không chỉ có H2O mà rất đa dạng như các dung dịch axit, kiềm… Ví dụ trong quá trình hoà tách Zn trong dung dịch H2SO4, cần đề cập đến hệ H2O-Zn-S (hệ 4 nguyên). Quá trình điện phân Sn trong dung dịch H2SiF6, ta cần đề cập đến hệ H2O-Sn-Si-F (hệ 5 nguyên). Các giản đồ trạng thái E-pH đa nguyên không có sẵn trong cẩm nang tra cứu, do đó khi đề cập đến hệ dung dịch nào ta phải tự nghiên cứu xác lập giản đồ của hệ dung dịch đó.
Nghiên cứu này, đề cập đến ý nghĩa của các giản đồ trạng thái và cách xác lập các giản đồ trong quá trình điện phân tinh luyện thiếc.
2. Phương pháp xác lập giản đồ cân bằng E-pH hệ đa nguyên
Một số khái niệm:
Đường giới hạn (đgh) là đường biểu diễn quan hệ hàm E=f(pH,Ci) đối với một phản ứng điện hóa (pưđh) hoặc quan hệ hàm pH=f(Ci) của một phản ứng hóa học (pưhh). Con số vẽ trên đường giới hạn chính là số thứ tự của phương trình pưđh và pưhh.
Để phù hợp với ngôn ngữ máy tính ta quy ước các iôn dương ký hiệu là `, ví dụ Sn`` thay cho Sn++, iôn âm ký hiệu là ’ ví dụ SO4’’ thay cho SO4-- .
Miền ưu tiên tồn tại (ngắn gọn là miền tồn tại - mtt) của một cấu tử (hoặc một chất) là miền giới hạn bởi các đgh, trong đó các cấu tử tồn tại có nồng độ tương đối lớn hơn các cấu tử khác có trong hệ.
Phương pháp xây dựng giản đồ trạng thái hệ 5 nguyên H2O-Sn-Si-F:
- Dùng phương pháp tính toán được trình bày trong các công trình đã công bố [1,2] - Sử dụng các giản đồ 3 nguyên có sẵn trong cẩm nang của Pourbaix [1]
- Ghép 2 hệ 3 nguyên H2O-F và H2O-Si thành hệ 4 nguyên H2O-F-Si (mới), tham khảo kết quả đã công bố trong các tài liệu [2,3].
- Ghép hệ 4 nguyên H2O-F-Si với hệ 3 nguyên H2O-Sn thành hệ 5 nguyên H2O-Sn-Si-F (mới)
- Xác định các chất mới xuất hiện trong hệ đa nguyên. Nhiệm vụ quan trong nhất trong quá trình lập giản đồ hệ đa nguyên mới là tìm xem có chất nào mới hình thành, sau đó tìm giá trị nhiệt động học hoá thế μ0 của nó. Khái niệm chất mới ở đây được hiểu là các chất mới hình thành khi ghép 2 hệ đã biết (cũ) với nhau, do các chất của 2 hệ cũ kết hợp với nhau tạo nên trong hệ mới. Nhiều khi biết được tên các chất mới hình thành nhưng không có dữ liệu nhiệt động học của nó cũng không thể xác định được miền tồn tại của nó trên giản đồ.
Trong hệ 4 nguyên H2O-F-Si có 2 chất mới hình thành là SiF4 và SnF62- . Trong hệ 5 nguyên H2O- Sn-Si-F chỉ thấy xuất hiện iôn SnF62- . Các dữ liệu nhiệt động học được được ghi trong bảng 1.
| Cấu tử | Trạng thái | μo (cal) | Ghi chú |
| SiF4 | dung dịch | - 370405 | Tài liệu [4] |
| SiF62- | dung dịch | - 511000 | Tài liệu [5] |
| SnF62- | dung dịch | - 420000 | Tài liệu [6] |
Bảng 1. Số liệu nhiệt động học của các cấu tử mới trong hệ H2O-Sn-F-Si
Với sự hỗ trợ của phần mềm tính NĐH đang được lưu giữ trong Bộ môn VL KLM và Compozit, trường Đại học BK HN, giản đồ E - pH đã được vẽ như hình 1 và 2 .
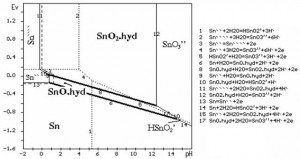
Hình 1. Giản đồ trạng thái cân bằng E-pH hệ H2O-Sn.
3. Ý nghĩa của giản đồ E - pH trong điện phân thiếc
3.1. Giản đồ hệ 3 nguyên H2O-Sn
Giản đồ hệ H2O-Sn tuy có sẵn trong tài liệu [1], nhưng để phân tích ứng dụng dễ dàng, nên dùng giản đồ hình 1 do máy tính vẽ. Trong đó chủ yếu thể hiện các cấu tử với hoạt độ là 1.
Khi nghiên cứu quá trình điện phân kim loại trong một dung dịch mà tương tác của các ion kim loại với các iôn trong dung dịch (ghép hệ H2O-Me và hệ dung dịch điện phân axit hay kiềm) không hình thành một chất hoặc một iôn nào mới, hoặc có nhưng không có số liệu nhiệt động học hoặc chất đó có độ hòa tan rất lớn thì có thể sử dụng ngay giản đồ hệ H2O-Me để khảo sát. Điện phân Sn trong dung dịch H2SO4 nằm trong trường hợp này (phần 3.4).
Giản đồ gồm có 2 hệ thống cân bằng: cân bằng giữa các iôn của Sn và cân bằng giữa các chất rắn với chất rắn, các chất rắn với các iôn của Sn.
Cân bằng giữa các iôn. Sn anôt hòa tan thành 2 loại iôn là Sn`` và Sn````. Miền tồn tại của các iôn giới hạn bởi các đường chấm chấm (…).
- Với pH nhỏ (pH<4), đầu tiên Sn tan ra ưu tiên tạo thành iôn Sn``. Điện thế tăng lên và vượt đgh 3, Sn```` bắt đầu chiếm ưu thế.
- Khi pH tăng lên và vượt giá trị đgh 2, Sn```` bắt đầu chuyển sang iôn SnO3’’. Sn`` ưu tiên chuyển sang iôn HSnO2’ khi pH lớn hơn đgh 1 và chuyển sang SnO3’’ khi pH lớn hơn đgh 4.
Cân bằng giữa các chất răn-rắn, rắn-iôn. Khi tăng điện thế, quá trình cực điện tùy theo pH có thể xảy ra 3 miền như sau:
1. Miền rắn-lỏng: Sn - Sn`` - Sn````
a. Khi pH -0,136V, Sn kim loại bắt đầu tan ra thành Sn``. Càng tăng điện thế, Sn`` và Sn```` được hình thành nhưng Sn`` vẫn chiếm ưu thế chừng nào điện thế vẫn ở dưới đgh 3, sau đó Sn```` sẽ ưu tiên tồn tại.
b. Khi pH có giá trị giữa đgh 11 và đgh 9 - môi trường axit mạnh. Nếu điện áp lớn hơn đgh 15, Sn`` sẽ ôxy hóa thành Sn```` nhưng ngay lập tức bị thủy phân và ưu tiên tồn tại dưới dạng Sn(OH)4.
2. Miền rắn - rắn:
Sn - Sn(OH)2 - Sn(OH)4 Khi pH có giá trị > đgh 9 và < đgh 12 - môi trường từ axit yếu đến kiềm yếu.
Sn hòa tan nhưng không ưu tiên thành các iôn mà bị thủy phân và tồn tại dưới dạng hyđrôxit ở điện thế thấp hơn đgh 8 là Sn(OH)2 hoặc là Sn(OH)4 trên đgh 8.
3. Miền rắn – lỏng: Sn – HSnO2’ – SnO3’’
a. Khi pH > đgh 12 và <đgh 10 - môi trường kiềm yếu.
Sn sẽ hòa tan sau đó thủy phân ưu tiên thành Sn(OH)2 theo đgh 6. Khi điện thế tăng lên trên đgh 17, Sn(OH)2 sẽ bị ôxy hóa và ưu tiên tan ra thành SnO3’’.
b. Khi pH > đgh 10 - môi trường kiềm mạnh.
Sn trực tiếp tan ra thành HSnO2’ theo đgh 14, sau đó ôxy hóa thành SnO3’’ theo đgh 5.
Nhận xét:
- Theo độ pH, hành vi của Sn trong hệ thống điện hóa được chia ra 3 miền rõ rệt (hình 1):
Miền1: trong môi trường axit mạnh, Sn hòa tan thành các iôn Sn`` và Sn```` giới hạn bởi các đgh 13-9-15-11 và trục tọa độ. Trong lĩnh vực ăn mòn kim loại người ta gọi miền này là miền ăn mòn (cor- rosion).
Miền 2: trong môi trường axit yếu, trung tính và kiềm yếu, Sn hòa tan ra và bị thủy phân thành Sn(OH)2 và Sn(OH)4 giới hạn bởi các đgh 11-15-9- 6-10-17-12 và trục tọa độ. Miền này còn có tên gọi là miền thụ động (passivation).
Miền 3: trong môi trường kiềm mạnh, Sn tan ra thành iôn HSnO2’ và SnO3’’, giới hạn bởi các đgh 14-10-17-12 và trục tọa độ. Miền này cũng có tên gọi miền ăn mòn.
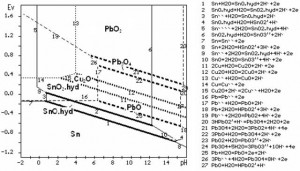
- Khi hòa tan anôt Sn trong môi trường axit (miền 1), miền ưu tiên hòa tan ra iôn Sn`` và Sn```` rất hẹp. Khi giảm hoạt độ cân bằng các iôn Sn trong hệ xuống 0,2mol/l, tức tương đương nồng độ (23-24)g/l, miền này mở rộng thêm về phía tay phải như đường đứt đoạn tới giá trị khoảng pH = 1.1 với iôn Sn``, pH = 0.08 với iôn Sn```` (hình 1), nhưng so sánh với miền ưu tiên hòa tan ra các iôn của các kim loại khác như Cu và Pb vẫn là rất hẹp. Nói một cách khác, so với Cu và Pb, Sn hòa tan thành các iôn trong môi trường axit rất mạnh. Nhận xét này được minh chứng trên hình 2, trong đó biểu diễn đồng thời giản đồ trạng thái của hệ H2O-Cu (đường chấm chấm) và hệ H2O-Pb (đường chấm gạch).
Hình 2. Giản đồ trạng thái E-pH hệ H2O-Sn-Cu-Pb
- Nồng độ iôn Sn khi bị thủy phân khá thấp. Tính toán theo pưhh
Sn``+H2O = Sn(OH)2+2H` pH = 0.75 - 0.5log(sn``) (1) Sn````+2H2O = Sn(OH)4+4H` pH = - 0.255 - 0.25log(Sn````) (2)
Kết quả cho biết nồng độ iôn Sn```` và Sn`` khi bị thủy phân theo pH (bảng 2). Với pH=1, chỉ với nồng độ Sn```` = 6g/l, Sn``=71,6g/l chúng đã bị thủy phân. Khi hoạt độ các iôn Sn bằng 1, pH thủy phân tương ứng của Sn`` và Sn```` là 0,75 và - 0,255.
| Độ pH | H2SO4 tự do g/l | iôn H` g/l | iôn Sn`` (p.ư 1) g/l | iôn Sn````(p.ư 2) g/l |
| 0 | 49 | 1 | 528,8 | 327,2 |
| 0,7 | 9,8 | 0,2 | 130,4 | 19,9 |
| 0,75 | 8,7 | 0,2 | 118,0 | 16,3 |
| 0,8 | 7,8 | 0,2 | 106,8 | 13,3 |
| 1,0 | 4,9 | 0,1 | 71,6 | 6,0 |
| 1,4 | 2,0 | 0 | 32,2 | 1,2 |
| 1,6 | 1,2 | 0 | 21,6 | 0,5 |
| 5,0 | 0 | 0 | 0,024 | 0 |
Bảng 2. Nồng độ bão hoà của các iôn theo pH (lấy hệ số hoạt độ của các iôn bằng 1)
Từ đây ta có thể rút ra nhận xét là trong quá trình hòa tan anôt, Sn tan ra thành các iôn trong một miền rất hẹp, pH thấp, nồng độ của các iôn khi bị thủy phân rất nhỏ so với nồng độ bão hòa của các muối của chúng. Quá trình thụ động anốt dễ xảy ra do các iôn của chúng rất dễ bị thủy phân, ngay cả khi nồng độ của các iôn Sn không cao và pH của dung dịch thấp.
- Khi hòa tan trong môi trường kiềm (miền 3), miền tồn tại iôn HSnO2’’ và SnO3’’ khá rộng so với các kim loại nặng khác (xem hình 2). Với kim loại Cu không tìm thấy miền tồn tại các iôn bazơ của nó. Với kim loại Pb miền tạo thành các iôn bazơ chỉ trong môi trường kiềm cực mạnh (pH>15).
Từ cơ sở phân tích giản đồ trạng thái ta thấy có thể tiến hành điện phân Sn trong cả môi trường axit mạnh và kiềm mạnh.
3.2. Giản đồ trạng thái hệ 4 nguyên H2O-Sn-S (hệ dung dịch điện phân Sn-H2SO4)
Khi ghép 2 hệ 3 nguyên H2O-Sn và H2O-S ta được hệ 4 nguyên H2O-Sn-S hoặc là hệ Sn- H2SO4. So với hệ 3 nguyên thấy xuất hiện 2 chất mới là SnSO4 và Sn(SO4)2. Chất rắn SnSO4 tan rất nhiều trong nước và axit [8] và không có số liệu nhiệt động học nên không thể khảo sát tiếp được. Giá trị hóa thế của chất rắn Sn(SO4)2 được tìm thấy trong tài liệu [6] là μ0 = -346800cal, từ đây tính được hoạt độ hòa tan là khoảng 120mol/l. Độ hòa tan của Sn(SO4)2 quá lớn và không tìm thấy miền tồn tại của nó trên giản đồ.
Vậy kết quả khảo sát hệ H2O-Sn (hình 1) có thể áp dụng được cho hệ Sn-H2SO4.
4. Kết luận
Đã nghiên cứu lý thuyết quá trình điện phân tinh luyện Sn trên cơ sơ giản đồ trạng thái cân bằng Pourbaix và rút ra kết luận sau:
- Sn có thể hòa tan anôt trong cả môi trường axit và kiềm mạnh.
- Khi điện phân trong môi trường H2SO4, miền tồn E-pH tại của các iôn thiếc rất hẹp. Khi hoạt độ các iôn Sn là 1mol/l, pH thủy phân cho iôn Sn```` là -0,255, cho Sn`` là 0,75. Khi giảm nồng độ Sn, miền tồn tại của các iôn có tăng nhưng không đáng kể. Với nồng độ Sn tối thiểu trong sản xuất vào khoảng (23-24)g/l (hoạt độ tương đương 0,2mol/l) pH thủy phân của các iôn có tăng lên cho iôn Sn```` là - 0,08; cho iôn Sn`` là 1,1.
- Nồng độ các iôn bị thủy phân trong môi trường axit với pH =1 cũng rất nhỏ. Khoảng 6g/l với iôn Sn```` và 71,6g/l với iôn Sn``.
- Trong quá trình hòa tan anôt Sn, khi lớp bùn dầy lên, H` khuếch tán vào lớp sát anôt rất khó khăn dẫn đến pH tăng cao, mặt khác hàm lượmg các iôn thiếc khuếch tán ra khỏi lớp sát anôt bị hạn chế, hiện tượng thủy phân tạo các hyđrôxit Sn là không tránh khỏi. Xác suất anôt bị thụ động do muối Sn bị thủy phân là rất lớn.
[symple_box color="gray" text_align="left" width="100%" float="none"] Tài liệu trích dẫn.
- M. Pourbaix; Atlas of electrochemical equilibra, Pergamon Press, 1966
- Đinh Phạm Thái, Nguyễn Kim Thiết; Cơ sở lý thuyết của QTLK: Điện phân, NXB GD, 1997
- Nguyễn Kim Thiết; Nghiên cứu tính ổn định của dung dịch H2SiF6, Tạp chí Hoá học & ứng dụng, số 9-2003
- I.G. Rưss; Obsaia chimiia, XVI,3(1946) trang 331-340 (Dịch từ bản tiếng Nga)
- I.G. Rưss; Flo và các hợp chất vô cơ của nó (Dịch từ bản tiếng Nga), M., 1956
- W.M. Latimer; The Oxydation stades of the elements and their potentials in aqueous solutions, Prentise - Hall, Inc. 1959
- Nguyễn Kim Thiết; Chương trình tính nhiệt động học (Bm Vật liệu KL màu & compozit, ĐH BK Hà Nội)
- Iu. V. Kariakin và I. I. Angelov, Hoá chất tinh khiết, NXB Khoa học và Kỹ thuật, Hà Nội, 1976 (Dịch từ bản tiếng Nga)
[/symple_box][symple_clear_floats]