Điều chế dung dịch điện phân thiếc
06/12/2017
Nghiên cứu này giới thiệu các phương pháp chính để điều chế dung dịch SnSO4 sau đó lựa chọn và nghiên cứu trên mô hình trong phòng thí nghiệm, làm cơ sở áp dụng trong quy mô công nghiệp.
Preparation of electrolyte solution for tin
Nguyễn Kim Thiết, Phạm Kim Đĩnh, Đinh Tiến Thịnh Trường Đại học Bách khoa Hà Nội
TÓM TẮT
Đã nghiên cứu quy luật phân bố của nồng độ kim loại theo chiều cao của bể điện phân khi tiến hành quá trình trong bể có bố trí các điện cực nằm ngang. Kết quả thu được sử dụng để thiết kế, vận hành bể điện phân điều chế dung dịch trong sản xuất một cách hữu hiệu.
ABSTRACT
The distribution law of tin concentration in dependance on the higth of electrolytic cell with horizontal electrodes has been determined. The obtained results will be used to design and operate electrolytic cell of fabrication of electrolyte SnSO4 - solution
1. Mở Đầu
Để đáp ứng được yêu cầu thiếc sạch dùng cho các nhu cầu sản xuất: đồ hộp, bao bì trong công nghiệp thực phẩm cũng như xuất khẩu, một số nhà máy luyện thiếc ở nước ta đã áp dụng công nghệ điện phân tinh luyện thiếc trong dung dịch axit sunfuaric. Quá trình điện phân cần một lượng dung dịch SnSO4 khá lớn. Để chế tạo dung dịch này phải chọn được phương pháp thích hợp, vừa rẻ vừa nhanh. Nghiên cứu này giới thiệu các phương pháp chính để điều chế dung dịch SnSO4 sau đó lựa chọn và nghiên cứu trên mô hình trong phòng thí nghiệm, làm cơ sở áp dụng trong quy mô công nghiệp.
2. Thực nhiệm
2.1. Phương pháp điều chế dung dịch SnSO4
Có nhiều cách để sản xuất dung dịch SnSO4:
a. Dùng thiếc bột đẩy đồng ra khỏi dung dịch sunfat của nó:
Sn(bột) + CuSO4 = SnSO4 + Cu (1)
Phương pháp này chỉ có ý nghĩa nếu như chỉ cần một lượng nhỏ dung dịch và có sẵn bột thiếc và CuSO4. Mặt khác, việc làm sạch đồng ra khỏi dung dịch thu được là rất khó khăn.
b. Dùng phương pháp điện hóa, hòa tan thiếc sạch vào dung dịch axit H2SO4. Đối với một phòng thí nghiệm hoặc một nhà máy đang chuẩn bị điện phân thiếc thì đây là phương pháp rất lý tưởng, vì mọi điều kiện để điều chế dung dịch đều đã có sẵn như: thiết bị điện phân, thiếc và axít.
Trong nghiên cứu này đã chọn phương pháp điện hóa để nghiên cứu nhằm đưa ra một số thông số cần thiết cho quá trình.
2.2. Chọn công nghệ điều chế dung dịch SnSO4 bằng phương pháp điện hoá
Nguyên lý điều chế dung dịch muối điện phân bằng phương pháp điện hóa là phải tạo cho được 2 khoang anot và catốt riêng biệt, cho dung dịch axit mới vào khoang catốt, rút dung dịch muối hình thành ở khoang anốt, tạo không gian thích hợp để ngăn cản một cách tối đa lượng dung dịch muối được hình thành ở anốt khuếch tán tới catốt.
Tùy theo cách tạo ra các khoang anốt và catốt riêng biệt mà ta có thể phân thành các phương pháp điện hóa khác nhau:
- Phương pháp điện phân có màng ngăn
- Phương pháp điện phân thiên tích.
a.Phương pháp điện phân có màng ngăn
Phương pháp này được áp dụng nhiều trong điện phân kim loại, điển hình là điện phân tinh luyện Ni[1]. Catốt được cho vào trong một túi vải bằng vật liệu chịu axit có khung bằng gỗ hoặc chất dẻo, đủ không gian cho catốt không bị chạm vào túi. Màng ngăn cũng có thể làm bằng vật liệu khác như: gỗ xốp hoặc khoan lỗ, sứ xốp...
Thành công của phương pháp phụ thuộc vào thao tác vận hành điện phân. Đầu tiên cho một ít dung dịch axit H2SO4 vào trong bể (cả khoang anot và catốt và đóng điện. H2 phóng điện ở catốt và Sn tan ra ở anốt. Trong quá trình điện phân, dung dịch được nạp liên tục vào khoang catốt. Túi màng ngăn phải đảm bảo sao cho mức dung dịch trong khoang catốt thấm ra ngoài khoang anốt chậm, luôn đảm bảo có độ chênh lệch chiều cao dung dịch giữa 2 khoang. Đó là bí quyết để ngăn cản không cho iôn Sn2+ hình thành ở khoang anốt khuếch tán vào khoang catot. Màng ngăn catot trong trường hợp này có tác dụng ngăn dòng ion thiếc bằng dòng dung dịch chảy cơ học ngược chiều qua lỗ mao quản của màng ngăn do áp lực của chênh lệch chiều cao dung dịch giữa 2 khoang chứ không phải là màng lọc ion.
Nạp tiếp axit vào khoang catốt cho đến độ cao theo dự kiến thì bắt đầu rút dung dịch SnSO4 ở đáy bể ra. Lượng dung dịch Sn2+ rút ra phải tính toán sao cho tương ứng với lượng axit cho vào và cân bằng với lượng Sn2+ đã hòa tan được.
Phương pháp này rất đơn giản nhưng cần phải có các vật liệu làm màng ngăn chịu axit. Điện áp bể điện phân có màng ngăn lớn, nhiệt độ dung dịch khá cao (60-80°C), nên tiêu hao điện năng cao. Mặt khác, iôn thiếc hoà tan ra không tập trung nên rất khó thu được dung dịch có hàm lượng iôn thiếc cao.
b.Phương pháp điện phân thiên tích
Trong dung dịch, các kim loại nặng như: Cu, Pb, Sn... các ion của chúng có xu thế bị thiên tích. Dung dịch để lắng sau một thời gian, ở đáy bể nồng độ thường cao hơn ở mặt bể. Ngược lại nếu cho muối tan được vào đáy bể, muối tan ra nhưng không thể khuếch tán đồng đều lên mặt bể. Tính chất này đã được lợi dụng để điều chế dung dịch điện phân và các muối vô cơ khác nhau. Có thể dùng bể điện phân với điện cực xếp dọc như trong các bể diện phân tinh luyện thông thường, hoặc dùng phương pháp xếp cực nằm ngang [1]. Trong công trình này phương pháp điện phân thiên tích với diện cực nằm ngang đã được chọn để nghiên cứu.
2.3. Mục đích và thiết bị nghiên cứu
Các iôn kim loại trong dung dịch có xu hướng thiên tích, nhưng phân bố các ion kim loại theo thời gian và chiều cao của dung dịch thì cho đến nay chưa thấy có các số liệu được công bố. Cho nên để có thể áp dụng thuộc tính này của các iôn kim loại vào quá trình điều chế dung dịch điện phân, cần có sự nghiên cứu một cách định lượng.
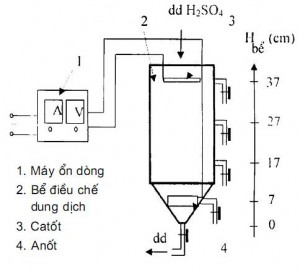
Sơ đồ thiết bị điện phân điều chế dung dịch SnSO4 theo phương pháp điện hóa cực ngang được mô tả trên hình 1. Khi iôn kim loại tan ra ở anốt, do thiên tích, nồng độ iôn Sn2+ sẽ tập trung nằm ở phần đáy bể phía dưới anốt. Dung dịch SnSO4 được tháo ra ở đáy bể dung dịch axit bổ sung được cho vào ở phía trên của bể điện phân. Quá trình thao tác phải đảm bảo sao cho không làm sáo trộn dung dịch trong bể điện phân.
Các thí nghiệm đã tiến hành với những điều kiện sau:
- Chế độ dung dịch: axit sunfuric 120g/l - Anốt sạch >99,95%Sn, đúc tấm - Catốt là thép tấm không gỉ - Mật độ dòng điện ia = (150 - 200)A/m2 - Thể tích bể điện phân: 4 lít
Hình 1. Sơ đồ cấu tạo bể điện phân chế tạo dung dịch
3. Kết quả và thảo luận
3.1. Nồng độ dung dịch lấy được theo thời gian điện phân
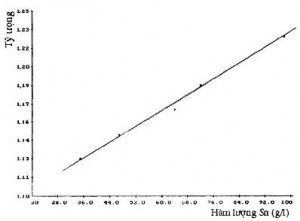
Lượng dung dịch Sn2+ rút ra theo thời gian điện phân được ghi trong bảng 1 và hình 2.
| Thời gian (h) | Lượng dd rút ra (ml) | Tỷ trọng (g/cm2) | Hàm lượng Sn (g/l) |
| 10 | 500 | 1,11 | 25 |
| 15 | 500 | 1,13 | 35 |
| 20 | 500 | 1,175 | 64 |
| 25 | 500 | 1,230 | 98 |
| 30 | 500 | 1,255 | 120 |
Bảng 1. Số lượng, nồng độ và tỷ trọng dung dịch theo thời gian điện phân (Da = 150A/m2)
Với thời gian diện phân là 10 giờ, rút ra 500 ml dung dịch, nồng độ thiếc chỉ đạt 30 g/l. Nhưng sau 25 giờ lượng dung dịch rút ra 500 ml đạt tới nồng độ 120 g/l.
Hình 2. Đồ thị quan hệ giữa tỷ trọng và hàm lượng thiếc trong dung dịch
Nhận xét:
- Thời gian chạy bể càng lâu, nồng độ iôn Sn2+ trong dung dịch càng cao. - Khi chạy bể ở mật độ dòng 150A/m2, dung dịch rất ổn định, không có hiện tượng thoát khí ôxy từ anốt do anốt bị thụ động.
3.2. Sự thay đổi nồng độ dung dịch theo chiều cao bể điện phân
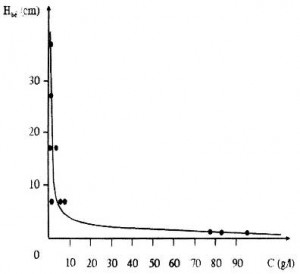
Trong quá trình nghiên cứu, đã khảo sát sự phân lớp của nồng độ Sn2+ theo chiều cao của bể điện phân. Kết quả trình bày ở bảng 2.
| Chiều cao bể (cm) | Hàm lượng Sn2+ (g/l) | ||
| 37 | 0,47 | 0,63 | 1,42 |
| 27 | 0,68 | 1,1 | 3,25 |
| 17 | 0,81 | 1,16 | 4,39 |
| 7 | 4,31 | 9,82 | 14,1 |
| 0,1 | 78,6 | 83,3 | 95 |
Bảng 2. Sự phân bố hàm lượng Sn2+ theo độ cao bể điện phân và thời gian (Da = 200A/m2).
Từ kết quả thu được, xử lý bằng chương trình máy tính [2] được đồ thị biểu diễn sự phân bố nồng độ dung dịch theo chiều cao bể điện phân như trên hình 3.
Hình 3. Sự phân bố hàm lượng thiếc theo chiều cao bể diện phân
Trong điều kiện mô hình thí nghiệm với chiều cao 30 cm kể từ mặt nằm ngang của anốt nồng độ thiếc thu được chỉ vào khoảng dưới 1 g/l, trong khi đó ở đáy bể (anốt 7 cm) nồng độ thiếc lên tới trên dưới 90g/1. Như vậy nồng độ của iôn Sn2+ trên mặt bể điện phân rất nhỏ nên lượng Sn2+ bị kết tủa rất ít, tức là lượng thiếc tan ra cơ bản thu được vào dung dịch. Trong trường hợp Tn3, thời gian hơi lâu (15h) từ dưới anốt xuất hiện các bọt nhỏ khí O2 do phân cực anốt tăng quá cao. Do các iôn Sn2+ bị cuốn theo bọt khí, nồng độ iôn Sn2+ ở sát mặt dung dịch (37 cm) bị tăng lên (1,42 g/l), do đó lượng Sn2+ kết tủa ở catốt tăng, đồng thời hiệu suất dòng điện cũng tăng theo (bảng 3). Từ các dữ liệu thực nghiệm này, bằng phần mềm đồ thị thực nghiệm [2], máy tính đã tìm ra phương trình hồi quy theo phương pháp bình phương nhỏ nhất như sau:
C = 52,9h-1,22 (2)
C: nồng độ ion thiếc, g/l, h: chiều cao tính từ đáy bể tới mặt catốt, cm. Nhận xét:
- Nồng độ iôn thiếc tập trung chủ yếu ở đáy bể (phía dưới anốt), càng dịch lên trên (gần catốt) nồng độ giảm đột biến.
- So với mật độ dòng anốt Da=150A/m2, thì khi Da= 200A/m2, tốc độ hòa tan nhanh hơn, nhưng nếu thời gian điện phân lâu (khoảng 15h) có xuất hiện hiện tượng thoát ôxy do thụ động anốt dù anốt là thiếc sạch 99,95%.
3.3. Quan hệ giữa hiệu suất dòng điện tính với thiếc ở catot và nồng độ Sn2+ ở lớp sát catốt
Dù cố gắng đến mức nào chăng nữa, thiếc vẫn bị kết tủa ít nhiều ở catốt do không thể ngăn cách triệt để các iôn thiếc di chuyển đến catốt. Lượng thiếc kết tủa ở catốt được đánh giá bằng hiệu suất dòng điện catốt đối với thiếc như bảng 3.
| Số thứ tự thí nghiệm | Tn1 | Tn2 | Tn3 |
| Thời gian thí nghiệm (h) | 10 | 12 | 15 |
| Nồng độ Sn ở sát catốt (%) | 0,47 | 0,63 | 1,42 |
| Hiệu suất dòng catốt η (%) | 1,05 | 1,4 | 3,2 |
| Ghi chú | Tốt | Tốt | Có bọt khí |
Bảng 3. Quan hệ giữa hiệu suất dòng catốt với nồng độ thiếc ở sát lớp catốt (mật độ dòng 200Alm2)
Trong công nghiệp do chiều cao bể lớn hơn nhiều, khoảng cách từ mặt catốt tới anốt rất xa, nồng độ dung dịch ở lớp sát catốt sẽ nhỏ hơn nhiều so với trong thí nghiệm, do đó có thể điều chế được dung dịch có hàm lượng thiếc cao với hiệu suất kết tủa ở catốt là rất nhỏ.
4. Kết luận
- Bằng phương pháp điện hoá thiên tích đã điều chế được dung dịch có hàm lượng thiếc cao (120g/l và hơn nữa), tuỳ thuộc vào thời gian và lượng dung dịch rút ra.
- Đã tìm ra quy luật phân bố nồng độ thiếc theo chiều cao của bể điện phân trong quá trình điều chế dung dịch điện phân SnSO4 theo phương pháp điện phân thiên tích với bể điện cực ngang. Sự phân bố đó có dạng đường y=axn
cụ thể là: C = 52,9 h-1.22.
- Hiệu suất kết tủa catốt tăng theo nồng độ Sn ở sát bề mặt catốt. Cần khống chế mật độ dòng điện Da, thời gian rút dung dịch hợp lý để không xảy ra thụ động anốt, hiệu suất kết tủa thiếc ở catot sẽ rất thấp và hiệu suất tạo dung dịch sẽ rất cao.
- Khi điện phân thiên tích, nhiệt độ dung dịch (30 - 40°C) thấp hơn so với khi điện phân có màng ngăn nên hạn chế được sự bốc hơi axit. Với kết quả thu được hoàn toàn có thể tính toán và điều khiển quá trình chế tạo dung dịch một cách hợp lý. Khi đạt tới nồng độ theo yêu cầu ở đáy bể, có thể rút dung dịch ra liên tục một lượng tương ứng với lượng thiếc hòa tan ra. Do chiều cao bể công nghiệp lớn nên nồng độ thiếc trên mặt bể (catốt) rất nhỏ, lượng thiếc kết tủa có thể coi như bằng không, hiệu suất tạo dung dịch xấp xỉ 100%.
[symple_box color="gray" text_align="left" width="100%" float="none"]
Tài liệu trích dẫn- Đinh Phạm Thái, Nguyễn Kim Thiết; Lý thuyết các quá trình Luyện kim: Điện phân, NXB GD, 1997
- Nguyễn Kim Thiết, Phần mềm vẽ đồ thị thực nghiệm, Bộ môn, Vật liệu kim loại màu & compozit, ĐHBK HN
[/symple_box][symple_clear_floats]