Ảnh hưởng của năng lượng cơ học đến nhiệt độ tổng hợp TiC từ TiO2 và muội than
06/12/2017
Trong những năm gần đây, một số công trình nghiên cứu đã sử dụng phương pháp nghiền năng lượng cao để tổng hợp TiC từ hỗn hợp TiO2 và muội than [5,6]. Tuy nhiên, các công bố đó mới nêu ra vấn đề, hoặc đưa ra những số liệu biểu kiến, mà chưa đề cập đến cơ chế cũng như những yếu tố ảnh hưởng đến quá trình tổng hợp TiC khi nghiền năng lượng cao.
Influence of mechanical energy on the synthesizing temperature of TiC from TiO2 and carbon soot
Trần Quốc Lập Trường Đại học Bách khoa Hà Nội Vũ Huy Thăng Khoa Hoá học, Tr. ĐH Khoa học tự nhiên, ĐHQG Hà Nội Email: Thangkhh@gmail.com Vũ Lai Hoàng Trường Đại học Kỹ thuật công nghiệp Thái Nguyên
Tóm tắt
Phương pháp nghiền năng lượng cao hỗn hợp bột TiO2 và muội than đã được thực hiện trong công trình này. Kết quả phân tích cấu trúc bằng nhiễu xạ Rơngen và phân tích nhiệt (DTA) của các hỗn hợp bột được nghiền với thời gian khác nhau, cho thấy quá trình nghiền năng lượng cao đã làm giảm nhiệt độ bắt đầu tạo TiC. Nghiền năng lượng cao cũng làm giảm hàm lượng ôxy của TiO2 bởi C, tạo ra các ôxit titan có hàm lượng ôxy thấp hơn. Hơn nữa, trong thời gian nghiền đã xảy ra phản ứng thế để tạo ra hợp chất TiOxCy.
Abstract
The high-energy mechanical milling of TiO2 and C powders was realized in this work. The analyzing of X-ray diffraction patterns and DTA curves of samples milled for different times, showed that the high-energy mechanical milling process reduced the temperature of initial synthesis of TiC. During ball milling, the reduction of oxygen con- tent in TiO2 and the formation of other titanium oxides with lower oxygen content were observed. Furthermore, some oxygen atoms can be replaced by carbon ones to form TiOxCy.
Keywords: High-energy milling, Store energy, Carbothermal reduction processes, Reaction mechanism, TiO2.
1. Đặt vấn đề
Cácbít titan (TiC) là hợp chất có những tính chất nổi trội như độ cứng cao (93 HRA), bền nhiệt (Tnc ≈ 3140°C) và chịu mài mòn, chịu va đập, song có tỷ trọng thấp (4,93 gam/cm3)[1-4]. Bởi vậy, nhiều ngành công nghiệp quan trọng như hàng không vũ trụ, chế tạo máy, hạt nhân nguyên tử v.v... có nhu cầu rất lớn về loại vật liệu này. Có nhiều phương pháp tổng hợp TiC như tự tổng hợp trực tiếp ở nhiệt độ cao, tổng hợp từ các khí halôgen titan và hyđrôcacbon và tổng hợp từ TiO2 và C. Tuy nhiên, tổng hợp TiC đòi hỏi nhiệt độ cao, thời gian dài.
Gần đây, phương pháp sử dụng tác nhân cơ học bằng cách nghiền năng lượng cao để tổng hợp vật liệu, đang thu hút sự quan tâm của nhiều nhà khoa học vật liệu. Bởi vì, nhiệt độ tổng hợp vật liệu đã giảm xuống khi nghiền năng lượng cao. Hỗn hợp bột đã nhận được một lượng năng lượng dự trữ, do hiệu ứng giảm kích thước hạt và sự biến dạng mạng tinh thể tạo ra. Sự giảm kích thước làm tăng năng lượng bề mặt, do tổng diện tích bề mặt tiếp xúc giữa các hạt tăng lên. Năng lượng bề mặt (ΔGsize) tăng lên được tính theo công thức (1):
ΔGsize = σ.ΔS (1)
trong đó :
σ - năng lượng bề mặt riêng, ΔS - tổng diện tích bề mặt tăng thêm.
Sự biến dạng mạng tinh thể và các khuyết tật mạng sinh ra khi đó làm tăng năng lượng tự do (ΔGdef) của hệ. Năng lượng tăng thêm này phụ thuộc vào độ biến dạng và bản chất của vật liệu, có thể được tính theo công thức (2):
Gdef = k.Δε (2)
trong đó :
k - hằng số phụ thuộc bản chất vật liệu, Δε - mức độ biến dạng.
Năng lượng tự do của hệ tăng lên sẽ làm giảm năng lượng hoạt hoá khuếch tán. Như vậy, theo định luật Fick thì hệ số khuếch tán của hỗn hợp bột nghiền sẽ được tính theo công thức (3):
D = Do exp[ -(ΔG+ΔGdef+ΔGsize)/RT] (3)
trong đó :
D - Hệ số khuếch tán ở nhiệt độ T, Do - Hằng số khuếch tán của vật liệu ở điều kiện tiêu chuẩn, ΔG - Năng lượng hoạt hoá khuếch tán của vật liệu không nghiền, R - Hằng số khí, T - Nhiệt độ.
Trong những năm gần đây, một số công trình nghiên cứu đã sử dụng phương pháp nghiền năng lượng cao để tổng hợp TiC từ hỗn hợp TiO2 và muội than [5,6]. Tuy nhiên, các công bố đó mới nêu ra vấn đề, hoặc đưa ra những số liệu biểu kiến, mà chưa đề cập đến cơ chế cũng như những yếu tố ảnh hưởng đến quá trình tổng hợp TiC khi nghiền năng lượng cao.
Mục đích bài viết này là phân tích một số yếu tố ảnh hưởng đến nhiệt độ tạo thành TiC.
2. Thực nghiệm
Bột TiO2 được sử dụng có kích thước nhỏ hơn 200 ìm và độ sạch trên 99 %. Cacbon được sử dụng là muội than có kích thước hạt nhỏ hơn 200 ìm. Tỷ lệ thành phần về khối lượng hỗn hợp bột tính theo phản ứng (4):
TiO2 + C = TiC + CO2 (4)
Hỗn hợp bột với tỷ lệ về khối lượng TiO2 : C là 68 : 32, được trộn đều và nghiền trong máy nghiền hành tinh Pulverisette 5. Tốc độ nghiền là 250 vòng/phút, tỷ lệ bi:bột là 10:1. Các mẫu được nghiền với thời gian là: 0; 6; 12; 18; 24; 30 và 36 giờ. Các mẫu nghiền và không nghiền được phân tích trên nhiễu xạ kế D8-Advance. Nhiễu xạ Rơngen được thực hiện với bức xạ CuKα và được phân tích nhiệt vi sai trên thiết bị Setsys Evolution 24 trong môi trường khí trơ.
3. Kết quả và thảo luận
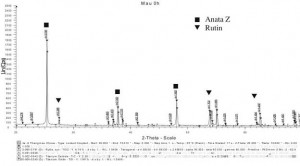
Từ giản đồ nhiễu xạ Rơngen của mẫu không nghiền (hình 1), thấy rằng píc của TiO2-anataz có cường độ lớn và sắc nét, píc của Rutin thấp hơn nhiều và không có píc của cacbon. Điều đó chứng tỏ bột TiO2 chủ yếu là anataz và cacbon có cấu trúc vô định hình.
Hình 1. Giản đồ nhiễu xạ Rơngen của mẫu không nghiền
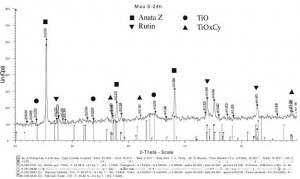
Trên giản đồ nhiễu xạ Rơngen của mẫu nghiền 24 giờ (hình 2) dễ dàng thấy cường độ các píc giảm xuống còn khoảng 1/3 so với mẫu không nghiền, các píc bị nhoà rộng, đồng thời thấy xuất hiện píc của các hợp chất TiO và TiOxCy. Các píc giảm cường độ và nhoà rộng có thể do kích thước hạt bột trở nên nhỏ mịn và có biến dạng dư trong mạng tinh thể. Theo Meerson và Lipkes, cũng như Berger, nhiệt độ để các phản ứng tạo TiO và TiOxCy, trong hỗn hợp bột TiO2 và C, xảy ra vào khoảng (1200- 1400) °C [7,8].
Hình 2. Giản đồ nhiễu xạ Rơngen của mẫu nghiền 24 giờ
Tuy nhiên, trong hỗn hợp bột nghiền 24 giờ tại nhiệt độ phòng đã thấy có các hợp chất TiO và TiOxCy. Sự tạo ra các hợp chất TiO và TiOxCy ở nhiệt độ thấp (nhiệt độ nghiền), chỉ có thể được giải thích bằng sự nghiền năng lượng cao và cơ chế của quá trình có thể hiểu như đề xuất của Berger [8] là xảy ra qua 3 bước: Bước 1 là quá trình làm giảm hàm lượng ôxy của TiO2 theo phản ứng:
TiO2 + (2-x)C → TiOx + (2-x)CO↑ (5)
Bước 2 là phản ứng tạo TiOxCy:
TiOx + 2yCO → TiOxCy + yCO2↑ (6)
CO2 được sinh ra khuếch tán qua lớp sản phẩm mới đến bề mặt hạt C để tạo ra CO theo phản ứng (7):
C + CO2 = 2CO↑ (7)
Bước 3 là phản ứng tạo TiC từ CO được sinh ra và TiOxCy theo phản ứng (8):
TiOxCy + CO → TiC + (CO;CO2)↑ (8)
Để phản ứng (5) xảy ra trong trạng thái rắn, cần phải tạo được bề mặt tiếp xúc giữa TiO2 và C. Bề mặt tiếp xúc này đã được tạo ra do sự hàn trong quá trình nghiền. Tốc độ phản ứng trên sẽ giảm nhanh chóng, do hình thành một lớp sản phẩm của phản ứng ngăn cản quá trình khuếch tán. Tuy nhiên, quá trình nghiền tiếp theo sẽ tạo ra các bề mặt tiếp xúc mới và quá trình làm nghèo ôxy trong hỗn hợp tiếp tục xảy ra.
Như vậy, thời gian nghiền càng tăng lên, thì ôxit titan nghèo ôxy càng có nhiều trong hỗn hợp. Trên bề mặt tinh thể các ôxit titan nghèo ôxy này tồn tại những nút trống Schottky. Các nút trống này được Zaiervald gọi là “cái bẫy” đối với nguyên tử C và góp phần tạo ra hợp chất TiOxCy. Thời gian nghiền càng tăng thì các tiền chất (TiO;TiOxCy) của TiC càng nhiều. Trên giản đồ nhiễu xạ Rơngen của các mẫu đã không thấy xuất hiện hợp chất TiC. Do điều kiện nghiền không đủ để phản ứng (8) xảy ra.
Để tổng hợp TiC nhất thiết có giai đoạn nung. Một yếu tố quan trọng thúc đẩy quá trình khuếch tán, là sự tăng nhiệt độ trong khi nghiền. Chỉ cần nhiệt độ tăng ít cũng đủ thúc đẩy quá trình này, bởi hệ số khuếch tán phụ thuộc vào nhiệt độ theo hàm mũ. Trong quá trình nghiền năng lượng cao, tốc độ của các viên bi nghiền rất lớn. Do vậy, tại vị trí va đập giữa các viên bi nhiệt độ có thể cao.
Tuy nhiệt năng sinh ra sẽ nhanh chóng truyền vào môi trường, song nó cũng ảnh hưởng rất lớn đến quá trình tạo ra các hợp chất mới TiO và TiOxCy. Như vậy, khi nghiền hỗn hợp bột TiO2 và muội than, ngoài sự giảm kích thước hạt và biến dạng làm tăng năng lượng tự do của hệ, còn có sự sinh ra các hợp chất mới. Chênh lệch entanpi của hệ trước và sau khi nghiền đã bổ sung vào năng lượng dự trữ mà hỗn hợp bột nhận được.
Năng lượng dự trữ này sẽ cải thiện quá trình nung tổng hợp TiC sau đó. Tuy nhiên, vấn đề cốt lõi của quá trình nghiền năng lượng cao là sự hàn nguội các hạt bột khác chất lại với nhau. Điều này cho phép quá trình khuếch tán và tạo ra các hợp chất mới xảy ra ở nhiệt độ thấp. Để nghiên cứu ảnh hưởng của nghiền năng lượng cao đến quá trình tổng hợp TiC từ TiO2 và muội than, ở đây đã sử dụng phương pháp phân tích nhiệt vi sai.
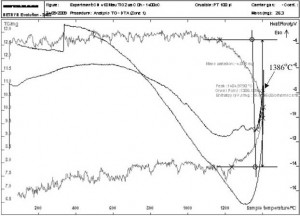
Hình 3. Đường cong DTA của mẫu không nghiền
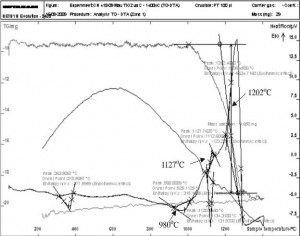
Hình 4. Đường cong DTA của mẫu nghiền 18 giờ
Hình 3 là đường cong phân tích nhiệt (DTA) của mẫu không nghiền. Từ đây thấy rằng, TiO2 bền vững đến nhiệt độ 1386 °C. Tại nhiệt độ này, trên đường cong xuất hiện píc toả nhiệt. Píc này xuất hiện do phản ứng tạo TiC.Đường cong DTA của mẫu nghiền 18 giờ (hình 4) cho thấy một píc thu nhiệt ở nhiệt độ khoảng 980 °C. Píc này xuất hiện là do các phản ứng làm giảm hàm lượng ôxy trong hỗn hợp để tạo ra TiO. Píc toả nhiệt trên đường cong do phản ứng tạo ra TiOxCy bắt đầu ở nhiệt độ 1127 °C. Một píc tỏa nhiệt lớn bắt đầu xuất hiện ở nhiệt độ 1202°C, chính là kết quả của phản ứng tạo thành TiC:
(TiOxCy;TiO) + C → TiC + CO/CO2 (9)
Píc này kết thúc ở nhiệt độ khoảng 1300 °C. Như vậy có thể xem là phản ứng tạo thành TiC đã xảy ra hoàn toàn.
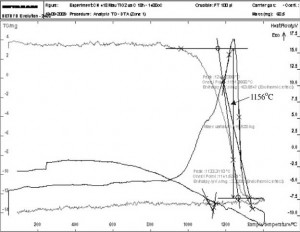
Hình 5. Đường cong DTA của mẫu nghiền 36 giờ
Hình 5 là đường cong DTA của mẫu nghiền 36 giờ. Nhiệt độ bắt đầu phản ứng tạo thành TiC ở mẫu này đã giảm xuống chỉ còn 1156°C. Như vậy, nhiệt độ phản ứng tạo thành TiC đã giảm được 180°C sau 18 giờ nghiền và 230°C sau 36 giờ nghiền. Từ kết quả phân tích nhiệt vi sai, đã xác định được sự phụ thuộc của nhiệt độ bắt đầu phản ứng tạo TiC vào thời gian nghiền (bảng 1 và hình 6).
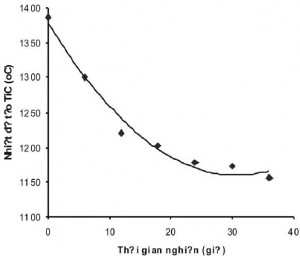
Hình 6. Sự phụ thuộc của nhiệt độ bắt đầu phản ứng tạo TiC vào thời gian nghiền
Bảng 1 Sự phụ thuộc của nhiệt độ bắt đầu phản ứng tạo TiC vào thời gian nghiền
| t (giờ) | 0 | 6 | 12 | 18 | 24 | 30 | 36 |
| T (°C) | 1386 | 1301 | 1230 | 1202 | 1179 | 1172 | 1156 |
Thấy rằng, nhiệt độ bắt đầu tạo TiC giảm xuống theo thời gian nghiền. Tuy nhiên, sau 18 giờ nghiền thì sự suy giảm nhiệt độ ngày càng ít. Sau 24 giờ nghiền nhiệt độ bắt đầu phản ứng hầu như không thay đổi. Trong giai đoạn nghiền đến 18 giờ, nhiệt độ bắt đầu phản ứng tạo TiC giảm mạnh theo thời gian nghiền. Điều này có thể giải thích rằng, trong giai đoạn này quá trình giảm kích thước hạt, sự biến dạng trong các hạt bột và tạo ra các tiền hợp chất của TiC đang xảy ra.
Như vậy, năng lượng dự trữ mà hỗn hợp bột nhận được tăng lên do cả 3 yếu tố trên. Sau 18 giờ, quá trình nghiền đã đạt trạng thái cân bằng: khả năng giảm kích thước hạt không còn nữa, độ biến dạng trong vật liệu đã đạt mức bão hòa. Năng lượng dự trữ mà hỗn hợp bột nhận được chỉ còn do sự tạo ra các tiền hợp chất của TiC.
Điều đó làm cho sự phụ thuộc của nhiệt độ bắt đầu phản ứng vào thời gian nghiền giảm xuống. Sau 36 giờ nghiền, phản ứng tạo ra các tiền hợp chất của TiC đạt đến trạng thái cân bằng. Điều này làm cho nhiệt độ bắt đầu phản ứng tạo TiC phụ thuộc không đáng kể vào thời gian nghiền.
4. Kết luận
Nghiền năng lượng cao đã cung cấp cho hỗn hợp bột TiO2 và muội than một năng lượng dự trữ do sự giảm kích thước hạt, biến dạng mạng tinh thể hạt bột và tạo ra các tiền hợp chất của TiC. Năng lượng dự trữ này đã làm giảm nhiệt độ tổng hợp TiC.
Nhiệt độ phản ứng tạo thành TiC đã giảm được 180 oC sau 18 giờ nghiền và 230 oC sau 36 giờ nghiền. Thời gian nghiền càng tăng càng làm giảm nhiệt độ bắt đầu phản ứng tạo thành TiC. Thời gian nghiền tối ưu cho hỗn hợp bột TiO2 và muội than là khoảng từ 18 đến 24 giờ.
[symple_box color="red" text_align="left" width="100%" float="none"]
Tài liệu tham khảo
- Г. В. Самсонов; Тугоплавкие соединения, Государственное научно-техническое издателъство, Москва, 1963
- P. Kиффep, П. Швapцкoпф; Твepдыe cплaвы, Мeтaллypгиздaт, 1957
- Г. П. Лyчинсий; Химия титана, Химия, 1971 4.
- С. С. Кипарисов, Ю. В. Левинский; Карбид титана, Металлургия, Москва, 1987
- Trần Quốc Lập, Phạm Ngọc Diệu Quỳnh, Huỳnh Xuân Khoa; Công nghệ tổng hợp cácbít titan từ oxít titan và muội than, Hội nghị khoa học lần thứ 20 - Trường Đại học Bách khoa Hà Nội, 10/2006
- M. Razavi, M. R. Rahimipour, R. Kaboli; Synthesis of TiC nanocomposite powder from impure TiO2 and car- bon black by mechanically activated sintering, Journal of alloys and compounds, 460, 2008, 694-698
- L. -M. Berger, P. Ettmayer and B. Schultrich; Influencing factors on the carbothermal reduction of titanium dioxide without and with simultaneous nitridation, Int. J. of refractory metals & hard materials, 12, 1993-1994, 161-172
- L. -M. Berger, W. Gruner, E. Langholf, S. Stolle; On the mechanism of carbothermal reduction processes of TiO2 and ZrO2, Int. J. of refractory metals & hard materials, 17, 1999, 235-243
- C. Suryanarayana; Mechanical alloying and milling, Progress in Materials Science, 46, 2001, 1-184
[/symple_box][symple_clear_floats]